Получение и химические свойства алкенов: курс ЕГЭ и углубленный материал
Материал по курсу ЕГЭ по химии.
Получение алкенов.
1. Крекинг.
В промышленности возможно получение алкенов в ходе процесса термического крекинга. При высокой температуре происходит разрыв связи С-С в алканах с длинными углеродными цепочками, что приводит к образованию более коротких алканов и алкенов.
Например, при крекинге н-октана образуются бутан и бутен.
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH2=CH-CH2-CH3
В качестве второго примера можно привести крекинг гексадекана, ведущий к образованию октана и октена:
C16H34 → C8H18 + C8H16
2. Дегидрирование алканов.
При высокой температуре порядка 400-600°С и в присутствии катализатора (платина, никель, оксид хрома (III)) алканы могут дегидрироваться, то есть отщеплять водород. В результате образуются алкены и выделяется водород.
Например, из н-бутана дегидрированием можно получить два продукта – бутен-1 и бутен-2:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + CH3-CH=CH-CH3 (кат., t°C)
3. Дегидратация спиртов.
Спирты можно подвергнуть дегидратации, то есть отщеплению воды. Если молекула воды отщепляется от одной молекулы спирта, то такой процесс называется внутримолекулярной дегидратацией. В этом случае вода отщепляется «изнутри» молекулы спирта. Такой процесс как раз приводит к образованию алкенов. Для того чтобы отщепление воды произошло, необходимо использовать водоотнимающие агенты, например, концентрированную серную кислоту или оксид алюминия. При этом важно, чтобы температура процесса была выше 140°С. Если температура будет ниже, то процесс дегидратации станет межмолекулярным, то есть молекула воды будет отщепляться не от одной, а от двух молекул спирта. В этом случае образуется не алкен, а простой эфир.
Типичной реакцией в ЕГЭ является дегидратация этанола с образованием этилена в качества продукта.
CH3-CH2-OH → CH2=CH2 + H2O (H2SO4 (конц.), 150°С)
Также встречается дегидратация бутанола-2. В ее рамках у сдающих экзамен проверяется знание правила Зайцева. Правило Зайцева гласит: при дегидратации или дегидрогалогенировании, ведущих к образованию двойной связи, образуется наиболее замещенный алкен. То есть такой алкен, при двойной связи которого наибольшее число заместителей-радикалов. Поэтому при дегидратации бутанола-2 образуется не бутен-1, а более замещенный бутен-2:
CH3-CH(OH)-CH2-CH3 → CH3-CH=CH-CH3 + H2O (H2SO4 (конц.), 180°С)
4. Дегидрогалогенирование.
Алкен можно получить, действуя спиртовым раствором щелочи на галогенпроизводное алкана. Как правило, в ЕГЭ встречаются моногалогенпроизводные, то есть алканы, в которых только один атом водорода замещен на галоген. В эту реакцию важно брать именно спиртовой раствор щелочи. Если брать водный раствор, реакция будет протекать по-другому, и мы получим спирт вместо алкена.
В качестве примера можно привести дегидрогалогенирование 1-бромпропана, приводящее к образованию пропена:
СH2Br-CH2-CH3 + NaOH (спирт.) → CH2=CH-CH3 + NaBr + H2O
Если брать 2-бромбутан, то снова, как и при дегидратации, работает правило Зайцева и вместо бутена-1 образуется более замещенный бутен-2:
CH3-CHBr-CH2-CH3 + NaOH (спирт.) → CH3-CH=CH-CH3 + NaBr + H2O
5. Дегалогенирование дигалогеналканов.
Если дигалогеналкан содержит два атома галогена при соседних атомах углерода, то на него можно подействовать цинком, что приведет к образованию алкена.
Ниже приведен пример получения бутена-2 из 2,3-дибромбутана:
CH3-CHBr-CHBr-CH3 + Zn → CH3-CH=CH-CH3 + ZnBr2
Важно, чтобы атомы галогена находились именно у соседних атомов углерода. Если они будут разделены метиленовыми группами –СH2– то в результате этой реакции получатся на алкены, а циклоалканы.
Химические свойства алкенов.
1. Гидрирование.
Непредельные алкены можно превратить в предельные алканы путем гидрирования, то есть взаимодействия с водородом. Процесс проводится в присутствии катализатора. Если использовать очень активную платину, то не требуются ни давление, ни высокая температура.
Гидрирование пропена в таком случае приведет к образованию пропана.
CH3-CH=CH2 + H2 → CH3-CH2-CH3 (кат. Pt)
2. Галогенирование.
Алкены могут вступать в реакции присоединения с галогенами, например, бромом. При этом атомы галогена присоединяются к обоим атомам углерода при в двойной связи.
Присоединение брома к пропену, таким образом, приведет к образованию 1,2-дибромпропана:
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3
Реакцию можно проводить с бромной водой или с раствором брома в четыреххлористом углероде (CCl4). Растворы брома окрашены в желто-коричневый цвет, в ходе реакции бром расходуется и окраска исчезает. Поэтому обесцвечивание бромной воды – это качественная реакция на кратные связи (то есть не только двойную, но и тройную, потому что алкины тоже вступают в реакции присоединения с бромом).
3. Гидрогалогенирование.
Помимо галогенов алкены могут также присоединять галогеноводороды. В этом случае к углеродам при двойной связи соответственно присоединяются атомы водорода и галогена.
Простейшим примером может послужить образование бромэтана по реакции этилена с бромоводородом:
CH2=CH2 + HBr → CH2Br-CH3
Тем не менее, если бромоводород присоединять к пропену, то теоретически возможны два продукта, либо 1-бромпропан, либо 2-бромпропан. Это зависит от того, к какому углероду при двойной связи пойдет галоген, к первичному или вторичному. На практике, однако, реализуется преимущественно только один маршрут реакции, приводящий к образованию 2-бромпропана. Здесь работает правило Марковникова, которое говорит о том, что при присоединении галогеноводорода (а также воды) к двойной связи, атом водорода связывается с наиболее гидрогенизированным атомом углерода, то есть с тем, у которого уже есть наибольшее число атомов водорода. Атом галогена соответственно идет к тому углероду, у которого меньше водорода.
Поэтому при реакции бромоводорода с пропеном образуется 2-бромпропан:
CH2=CH-CH3 + HBr → CH3-CHBr-CH3
4. Радикальное замещение.
Взаимодействие галогенов и алкенов ведет к присоединению атомов галогена к углеродам при двойной связи. Скорее всего только эту реакцию потребуется знать для ЕГЭ. Тем не менее в некоторых школьных учебниках приводится пример принципиально иного взаимодействия галогенов с алкенами, а именно радикального. При высокой температуре порядка 400-500°С хлор не присоединяется к двойной связи, а по радикальному механизму замещает водород в так называемом аллильном положении, то есть в α-положении к двойной связи.
CH3-CH=CH2 + Cl2 → Cl-CH2-CH=CH2 + HCl (400-500°С)
Двойная связь при этом не разрушается. Эта реакция была известна еще в 19 веке, а в настоящее время применяется для получения хлористого аллила. Почему же не происходит присоединения хлора к двойной связи? Оно происходит, просто при такой высокой температуре процесс становится обратимым, а равновесие его практически полностью смещено в сторону исходных веществ.
5. Гидратация.
Гидратацией называются присоединение молекулы воды к кратной связи. Продуктом присоединения воды к двойной связи является спирт.
Так, взаимодействие этилена и воды дает этиловый спирт. Важно понимать, что процесс требует жестких условий, давления 60 атм и выше, а также температуры 300°С. Так что это исключительно промышленный процесс и в лабораторной практике не применяется. Катализатором реакции является ортофосфорная кислота, нанесенная на пористый оксид кремния (IV):
CH2=CH2 + H2O → CH3-CH2OH (60 атм, 300°С, кат. H3PO4/SiO2)
Присоединение воды тоже подчиняется правилу Марковникова, поэтому гидроксильная группа воды идет к тому атому углерода, у которого меньше атомов водорода. Это значит, что первичный спирт (этанол) можно получить по этой реакции только из этилена. Если брать пропен, бутены и так далее, будет образовываться вторичный спирт:
CH3-CH=CH2 + H2O → CH3-CHOH-CH3 (40 атм, 180°С, кат. H3PO4/SiO2)
CH2=CH-CH2-CH3 + H2O → CH3-CHOH-CH2-CH3 (p, t, кат.)
6. Полимеризация.
Наличие двойной связи в алкенах позволяет им полимеризоваться. В этом случае из индивидуальных молекул, называемых мономерами, получаются длинные сшитые химическими связями молекулы, называемые высокомолекулярными соединениями или полимерами. В курсе ЕГЭ нужно знать три реакции полимеризации алкенов – полимеризацию этилена, пропилена и винилбензола (стирола). Их схемы приведены ниже:
nCH2=CH2 → (-CH2-CH2-)n
nCH3-CH=CH2 → (-CH(CH3)-CH2-)n
nС6H5-CH=CH2 → (-CH(C6H5)-CH2-)n
Из этилена получается полиэтилен, из пропилена пропилен, а из стирола полистирол. Этилен, пропилен и стирол представляют собой мономеры, а полиэтилен, полипропилен и полистирол – полимеры.
Полимеризация алкенов протекает по механизму радикального присоединения, поэтому ее необходимо инициировать, то есть «запустить». Образование свободных радикалов стимулируют, вводя в реакцию смесь перекисные соединения, содержащие связь О-О, которые как раз способны распадаться с образованием радикалов под действием температуры и высокого давления.
7. Реакции окисления.
Алкены, будучи углеводородами, хорошо горят с образованием углекислого газа и воды. В общем виде реакция записывается следующим образом:
CnH2n + 3n/2O2 → nCO2 + nH2O
Тогда для этилена с n=2 можно записать:
CH2=CH2 + 3O2 → 2CO2 + 2H2O
Однако помимо горения у алкенов есть и более специфические реакции окисления. Их можно разделить на две группы – реакции жесткого и мягкого окисления. В первом случае слово «жесткий» означает, что будет происходить полный разрыв двойной связи С=С в алкене, то есть продуктами окисления будут две более короткие молекулы по сравнению с исходным алкеном. В курсе ЕГЭ жесткое окисление проводят с помощью перманганата калия KMnO4 в присутствии серной кислоты и при нагревании. В зависимости от положения двойной связи в исходном алкене возможны разные продукты.
Случай первый: у углеродов двойной связи есть по одному радикалу-заместителю. В такой ситуации продуктами жесткого окисления будут карбоновые кислоты, то есть углероды при двойной связи будут окисляться до карбоксильных групп –СOOH. Схема процесса показана ниже:
R1-CH=CH-R2 + KMnO4 + H2SO4 → R1-COOH + R2-COOH + K2SO4 + MnSO4 + H2O
Случай второй: двойная связь является концевой, то есть в алкене есть фрагмент =СН2. Здесь углерод, содержащий заместитель, также окисляется в карбоновую кислоту, а концевой углерод из фрагмента =СН2 окисляется в СО2. Ниже показана схема:
R-CH=CH2 + KMnO4 + H2SO4 → R-COOH + CO2 + K2SO4 + MnSO4 + H2O
Случай третий: углерод при двойной связи имеет два радикала-заместителя. Такой углерод окисляется до кетогруппы С=О, то есть продуктом является кетон. Это выглядит как показано ниже:
R1C(R2)=CH-R3 + KMnO4 + H2SO4 → R1-CO-R2 + R3-COOH + K2SO4 + MnSO4 + H2O
На анализе продуктов окисления алкена основан метод определения положения в нем двойной связи.
Также есть мягкое окисление. Слово «мягкое» означает, что полного разрыва связи С=С не происходит. В курсе ЕГЭ мы изучаем только одну реакцию мягкого окисления. Алкен взаимодействует с разбавленным водным раствором KMnO4 при 0°С. В ходе этого процесса к углеродам при двойной связи присоединяются гидроксильные группы –ОН, а сама двойная связь разрывается, превращаясь в одинарную. Фактически процесс является гидроксилированием, а реакция носит имя русского ученого Вагнера. Схема в общем случае представлена ниже.
R1-CH=CH-R2 + KMnO4 + H2O → R1-CHOH-CHOH-R2 + MnO2 + KOH
Больше примеров жесткого и мягкого окисления алкенов вы можете найти в этой статье.
В некоторых школьных учебниках приводится реакция промышленного получения окиси этилена. Процесс подразумевает окисление этилена кислородом воздуха в присутствии серебра в качестве катализатора и при нагревании. Окись этилена представляет собой трехчленный цикл с кислородом:

Из окиси этилена получают ряд ценных органических веществ, например, этиленгликоль.
Есть еще одна промышленная реакция окисления алкенов, которая изредка бывает в ЕГЭ. Это так называемый Вакер-процесс, в ходе которого этилен окисляется кислородом до ацетальдегида в присутствии хлорида палладия и меди (II).
2CH2=CH2 + O2 → 2CH3CHO (в присутствии PdCl2 и CuCl2)
С момента появления в 1960-х годах Вакер-процесс вытеснил способ получения ацетальдегида по реакции Кучерова, то есть гидратацией ацетилена.
Материал по углубленному курсу.
Получение алкенов.
1. Дегидрогалогенирование.
Мы уже говорили о том, что действием щелочи в спиртовом растворе можно отщепить галогеноводород в молекуле галогеноалкана. Это один из способов создания двойной связи. На самом деле для этой реакции годятся и другие сильные основания, например, трет-бутилат калия (t-BuOK) в трет-бутаноле или амид натрия. Ниже приведены реакции получения 1-метилциклогексена из 1-бром-1-метилциклогексана действием этих реагентов:

Вне зависимости от природы взятого основания отщепление галогеноводорода подчиняется правилу Зайцева.
2. Дегидратация спиртов.
Механизм дегидратации спиртов включает образование карбокатионов. Карбокатионы способы к перегруппировкам, целью которых является образование более устойчивой формы, причем эти процессы идут быстрее, чем отщепление катиона. Таким образом, в результате гидридного или алкильного сдвига возможно образование более устойчивого вторичного карбокатиона вместо первичного. Это можно увидеть на примере дегидратации бутанола-1.
На схеме ниже показаны четыре стадии этого процесса. На первой стадии происходит протонирование гидроксильной группы бутанола-1. На второй стадии вода отщепляется, что приводит к образованию первичного карбокатиона. Он гораздо менее устойчив, чем вторичный, поэтому на третьей стадии происходит миграция гидрид иона, то есть атома водорода с двумя электронами, от вторичного углерода к первичному, в результате чего положительный заряд карбокатиона локализуется на вторичном углероде. То есть образуется более устойчивый вторичный карбокатион. На заключительной стадии происходит отрыв протона, который может отщепляться от разных атомов углерода. Именно поэтому при дегидратации спиртов часто образуются несколько продуктов. В случае дегидратации бутанола-1 основным продуктом является транс-бутен-2.

Случаем перегруппировки также является расширение цикла при дегидратации циклобутилметанола. Схема процесса, которая приведена ниже, очень похожа на предыдущий случай. Сначала протонируется кислород гидроксильной группы, затем уходит вода, после чего образовавшийся первичный карбокатион превращается во вторичный за счет расширения цикла. В итоге продуктом дегидратации циклобутилметанола является циклопентен.

Такие перегруппировки, связанные с миграцией углерода, называются перегруппировками Вагнера-Меервейна.
3. Элиминирование по Гофману.
В базовом школьном курсе мы изучали правило Зайцева, гласящее, что при отщеплении воды или галогеноводорода от соответственно спирта или галогеналкана образуется наиболее замещенный алкен. В действительности правило Зайцева является не абсолютным законом, а всего одним из случаев отщепления. Вторым таким случаем, когда в результате отщепления образуется наоборот наименее замещенный алкен, является так называемое элиминирование (то есть отщепление) по Гофману.
Для этого процесса берут соль четвертичного аммония, которую обрабатывают оксидом серебра в горячем водном растворе. В результате получается гидроксид четвертичного аммония, который отщепляет амин и воду с образованием наименее замещенного алкена. В реакции ниже показано образование бутена-1:

4. Пиролиз сложных эфиров.
Если спиртовая часть сложного эфира содержит водород в β-положении по отношению к сложноэфирной группе, то такие эфиры при нагревании могут разлагаться на карбоновые кислоты и алкены. Ниже показано разложение изопропилацетата:
5. Реакция Чугаева.
Реакции дегидратации при получении алкенов имеют существенный недостаток, поскольку часто дают продукты изомеризации. Способом избежать изомеризации является реакция Чугаева, позволяющая селективно получать алкены из спиртов.
Схема получения бутена-1 из бутанола-1 по реакции Чугаева приведена ниже:

На первой стадии спирт обрабатывают щелочью и добавляют сероуглерод, результатом чего является соединение, относящееся к классу ксантогенатов. После обработки метилйодидом образуется метилксантогенат. Его нагревают при температурах выше 100°С и селективно получают бутен-1 без продуктов изомеризации.
6. Неполное восстановление алкинов до цис-алкенов.
Двойную связь можно создать путем неполного восстановления тройной связи. В общем случае при этом могут получаться как цис-, так и транс-алкены. Однако существуют препаративные методы, которые позволяют получать такие изомеры селективно.
Первый способ получить двойную связь из тройной заключается в использовании катализаторов гидрирования с пониженной активностью. Поэтому можно использовать активный палладий, но отравленный хинолином или ацетатом свинца (II). Также возможно использование ди-изо-бутилалюминийгидрида или DIBAL-H при низкой температуре. Наконец третий вариант заключается в использовании коллоидного никеля в качестве восстановителя. Его можно получить восстановлением ацетата никеля с помощью борогидрида натрия в спирте и в присутствии этилендиамина. Схематично все три способа показаны на рисунке ниже.
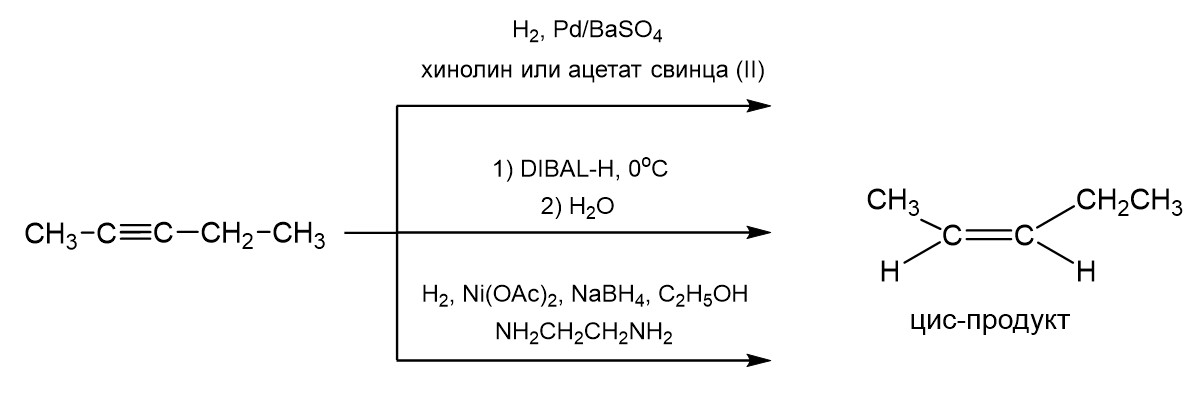
Все указанные способы ведут к образованию цис-алкена.
7. Неполное восстановление алкинов до транс-алкенов.
Тройную связь также можно селективно восстановить до двойной с образованием транс-алкена. В этом случае в качестве восстановителей можно использовать литийалюмогидрид при высокой температуре или натрий в жидком аммиаке.

8. Реакция МакМурри.
По этой реакции можно получить алкены конденсацией двух молекул карбонильных соединений. Восстановителем выступает, вероятно, нульвалентный титан, который сначала получают в реакционной смеси восстановлением соединений титана, например, алюмогидридом лития. В результате титан превращается в оксид, что очень выгодно термодинамически и поэтому является движущей силой процесса.

9. Реакция Виттига.
По реакции Виттига можно получить алкен из карбонильных соединений. На альдегиды или кетоны нужно воздействовать так называемыми илидами фосфора, то есть содинениями, в которых карбанион соединяется с гетероатомом, в нашем случае фосфором. Илиды фосфора можно получить восстановлением фосфониевых солей. Фосфониевые соли по аналогии с аммониевыми получают взаимодействием в случае фосфора трифенилфосфина с алкилгалогенидами, например, метилбромидом:
(C6H5)3P + CH3Br = (C6H5)3P+CH3Br-
Далее эту фосфониевую соль восстанавливают сильным восстановителем, например, гидридом натрия:
(C6H5)3P+CH3Br- + NaH = (C6H5)3P+CH2- + H2 + NaBr
То, что получилось, и есть илид, который участвует в реакции Виттига по схеме ниже:

10. Реакции Теббе и Петасиса.
Еще одним способом превратить карбонильное соединение в алкен являются похожие реакции Теббе и Петасиса. В обоих случаях сначала хлортитаноценовое соединение, содержащее циклы пентадиена, взаимодействуют с алкилметаллическими соединениями. На втором шаге получают титаноценовый реагент с двойной связью Ti=C.

Далее именно он и реагирует, например, с кетоном с образованием алкена, как показано на схеме ниже:

Химические свойства алкенов.
1. Гидратация по методу оксимеркурирования-демеркурирования.
Мы хорошо знаем процесс гидратации алкенов, приводящий к образованию спиртов. Однако у него есть существенный недостаток, а именно очень жесткие условия. Для гидратации этилена и пропилена необходимы высокие температура и давление. Поэтому в лабораторной практике такая гидратация не применяется. Альтернативой является так называемое оксимеркурирование, когда вместо воды на первом этапе к алкену присоединяется ацетат ртути (II). Такое взаимодействие основано на очень хорошей способности ртути образовывать химическую связь с углеродом. Далее связь Hg-C можно восстановить и мы получим спирт. Схема показана ниже:

Отметим, что гидратация по методу оксимеркурирования-демеркурирования протекает в соответствии с правилом Марковникова. Процесс не требует давления и осуществляется при комнатной температуре. Он обеспечивает высокие выходы спиртов и применяется в лабораторной практике.
2. Эпоксидирование (реакция Прилежаева)
Выше мы разбирали промышленное получение окиси этилена, однако такие окиси, называемые также эпоксидами, можно синтезировать на основе любых алкенов при в лабораторной практике. Для этого на алкены можно подействовать так называемыми надкислотами, то есть кислотами, содержащими перекисный фрагмент –О–О–. Обычно используют мета-хлорпербензойную кислоту или надтрифторукусусную кислоту. Ниже показана схема взаимодействия циклогексена с мета-хлорпербензойной кислотой:
Процесс проводится в неполярном растворителе и известен как реакция Прилежаева. Пероксокислоты иногда не получают специально, а синтезируют непосредственно в реакционной смеси, смешивая кислоту и пероксид водорода. Полученное эпоксидное кольцо может раскрываться под действием кислот и щелочей. В этом случае образуются гликоли, то есть двухатомные спирты.
3. Гидроксилирование тетраоксидом осмия OsO4.
Мы изучали реакцию Вагнера, то есть гидроксилирование алкенов под действием водного раствора KMnO4. Однако это не единственный способ ввести гидроксильные группы к углеродам при двойной связи. Еще одним агентом, позволяющим сделать это, является тетраоксид осмия OsO4. Не первом этапе в этой реакции образуется циклический эфир осмия, который разрушают гидросульфитом натрия. Это приводит к образованию двухатомного спирта.

Недостатком этой реакции является чрезвычайно высокая стоимость и токсичность тетраоксида осмия. Поэтому были разработаны методы гидроксилирования алкенов, в которых тетраоксид осмия является не реагентом, а катализатором, что позволяет использовать его значительно меньшие количества.
4. Озонолиз и разложение озонидов.
Мы уже говорили о том, что возможно окисление двойной связи с ее разрывом под действием перманганата калия. Однако этот процесс неселективный и сопровождается образованием побочных продуктов. Более избирательно его можно провести, используя в качестве окислителя озон. На первой стадии алкен обрабатывают озоном при низкой температуре, что ведет к образованию озонида.
Используют смесь 5-10% озона с кислородом при температуре -78°С. Полученный озонид разлагают, используя либо восстановитель, например, цинк, либо окислитель, например, пероксид водорода. В результате получают альдегиды и кетоны, как показано на схеме для озонида на основе тризамещенного алкена.

5. Гидроборирование.
Алкены способны вступать в реакции присоединения с боранами и алкилборанами. Если речь идет о незамещенном боране, то его используют в виде комплекса с тетрагидрофураном, поскольку простейший боран BH3 в индивидуальном виде недоступен. Алкилзамещенные бораны бывают разными по структуре, но в общем виде их можно обозначить как HBR2. Важно, что присоединение боранов к двойной связи происходит против правила Марковникова.

Полученное соединение можно превратить в алкан, обработав уксусной кислотой, или в спирт, подействовав щелочным раствором пероксида водорода.

Таким образом, с помощью гидроборирования можно осуществить фактически гидрирование алкена, а также его гидратацию против правила Марковникова.
Хотите хорошо подготовиться к ЕГЭ по английскому или химии или изучать английский для себя? Запишитесь на занятия к автору сайта.
Занятия проходят онлайн, в удобном формате, в подходящее для Вас время.


