Как решать задание 4 в ЕГЭ по химии: полное руководство.
Проверить знания по этой теме можно на тренажере по заданию 4.
В задании 4 ЕГЭ по химии дается несколько соединений и требуется найти среди них те, которые содержат ту или иную химическую связь или имеют тот или иной тип кристаллической решетки. Химическая связь может быть ковалентной полярной или ковалентной неполярной, ионной и донорно-акцепторной (о ковалентных связях вы можете прочитать этот материал). А кристаллическая решетка может быть молекулярной, атомной, ионной или металлической. Мы разберем все случаи этих заданий и покажем, что здесь можно следовать простым правилам или применять простые приемы.
Содержание
1. Выбор соединений с неполярной ковалентной связью.
2. Выбор соединений с полярной ковалентной связью.
3. Выбор соединений с донорно-акцепторной связью.
4. Выбор соединений с водородной связью.
5. Задания на типы кристаллических решеток.
1. Выбор соединений с неполярной ковалентной связью.
Неполярную ковалентную связь образуют одинаковые атомы по типу Э-Э, Э=Э или Э≡Э. Самые очевидные случаи представлены простыми веществами: H2, F2, Cl2, Br2, I2, O2, N2, S8, P4. Во всех этих соединениях есть связи Э-Э, которые могут быть одинарными, двойными или тройными. Но нужно знать и более сложные случаи. Это органические соединения с двумя или более связанными атомами углерода, потому что в них есть связь С-С. Это ацетилениды металлов, потому что в них есть связь С≡С. А также это пирит FeS2 (связь S-S) и пероксиды водорода или металлов (связь O-O). Посмотрим решение задач такого типа на примерах.
Задание 1.
Из предложенного перечня выберите два соединения, которые имеют ковалентную неполярную связь.
1) Na2O
2) CH3OCH3
3) N2
4) Na2O2
5) CaCl2
Иногда возникает ошибочное представление о том, что если в соединении есть два одинаковых атома, то в нем обязательно есть ковалентная неполярная связь. Это не так. Мало просто иметь два одинаковых атома. Важно, чтобы эти одинаковые атомы образовывали связь друг с другом. В нашем задании все пять соединений имеют по два одинаковых атома, но только два из этих соединений содержат неполярную ковалентную связь. Ниже это показано на рисунке.
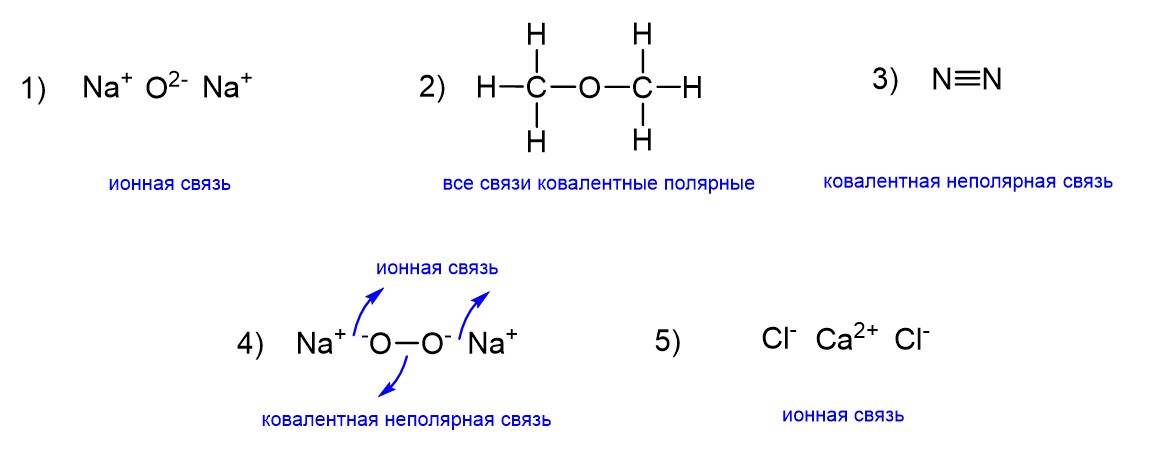
Первое соединение – это оксид натрия Na2O. Здесь два атома натрия, но они не образуют связь друг с другом. Это верно и для любого другого оксида одновалентного металла Ме2О. В таких оксидах ковалентной неполярной связи нет, потому что нет связи Ме-Ме. Далее идет органическое вещество диметиловый эфир. Да, здесь два атома углерода, но они снова не связаны друг с другом. Все связи ковалентные полярные. Третье соединение – это простое вещество азот. На рисунке показана ковалентная неполярная связь N≡N, так что такое соединение нам подходит. Также неполярная ковалентная связь есть и в пероксиде натрия Na2O2. Она образована атомами кислорода О-О. Отметим, что наличие ковалентной неполярной связи не исключает наличия и других типов связи, в нашем случае ионной – между катионами натрия и пероксидной группировкой. Наконец, в хлориде кальция атомы хлора связаны не друг с другом, а с катионом кальция. Поэтому здесь только ионная связь (она есть во всех солях). Ответ: 3, 4.
Задание 2.
Из предложенного перечня выберите два соединения, которые имеют ковалентную неполярную связь.
1) СH4
2) FeS2
3) CO2
4) Na2C2
5) H2SO4
Структурные формулы этих соединений с указанием типов связей приведены ниже.
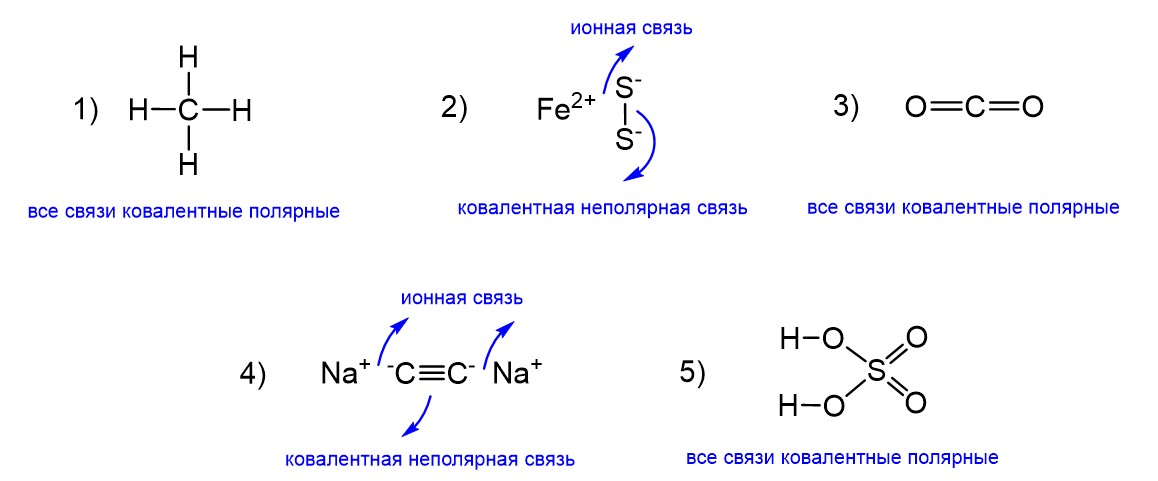
Первое соединение метан CH4 образовано четырьмя одинаковыми связями С-Н. Поскольку неполярных связей Н-Н здесь нет, то это соединение нам не подходит. А вот пирит FeS2 мы указывали как пример вещества с ковалентной неполярной связью. Она образована атомами серы S-S. Далее в молекуле СО2 нет связей О-О, поэтому ее мы отбрасываем. Следующий за ней ацетиленид Na2C2 мы тоже указывали среди веществ с неполярной ковалентной связью. Она образована атомами углерода C≡C. Наконец в серной кислоте тоже нет связей между одинаковыми атомами. В ее молекуле все связи ковалентные полярные. Поэтому нам для ответа подходят пирит и ацетиленид натрия. Ответ: 2, 4.
Отметим также, что иногда словосочетание «ковалентная неполярная связь» в условии задания может отсутствовать. Условие может звучать так: укажите соединения, которые содержат такую же связь, как в алмазе. Нужно понимать, что в алмазе есть связи С-С, то есть речь как раз идет о ковалентных неполярных связях. Вместо алмаза может быть предложен графит, хлор и так далее.
2. Выбор соединений с ковалентной полярной связью.
Распознать ковалентную полярную связь легко – она образована разными элементами. Единственная сложность, которая может возникнуть, связана с различением ковалентной полярной связи и ионной связи. Здесь достаточно запомнить случаи возникновения ионной связи. Она возникает в оксидах и гидроксидах металлов, а также солях. Во всех остальных ситуациях связь между разными атомами А и В всегда будет ковалентной полярной.
Задание 3.
Из предложенного перечня выберите два соединения, которые имеют ковалентные полярные связи.
1) H2SO4
2) NaI
3) Br2
4) K2S
5) CH4
Типы связей во всех предложенных соединениях показаны на рисунке ниже.
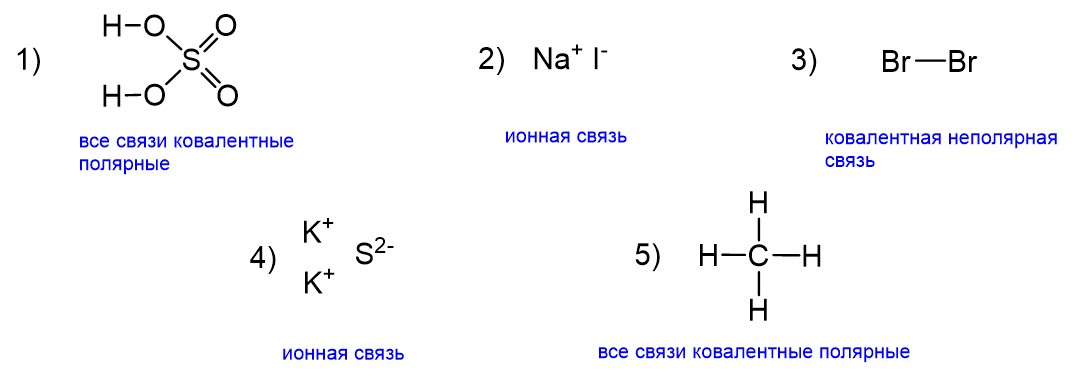
В серной кислоте все связи образованы разными элементами (H-O, S-O, S=O), поэтому они ковалентные полярные. Случаи ионной связи нам не подходят, поскольку перед нами не оксид, не гидроксид и не соль. Тем не менее часто возникает следующий вопрос. Серная кислота в воде распадается на ионы, что описывается уравнением электролитической диссоциации: H2SO4 ⇆ 2H+ + SO42-. Разве тогда две связи О-Н не должны быть ионными? Действительно, эти связи становятся ионными, но только вследствие поляризующего действия воды, то есть только в водном растворе. В безводной серной кислоте ионных связей нет. В задании 4 обычно даются индивидуальные вещества, а не растворы, поэтому мы считаем серную кислоту безводной.
Далее йодид натрия NaI представляет собой соль, значит, связь ионная. Следующая молекула Br2 образована одинаковыми атомами, следовательно, связь ковалентная неполярная. Сульфид K2S снова соль, поэтому связь ионная. А вот в метане CH4 все связи образованы разными элементами (С и Н) и одновременно не подходят под случаи ионных. Таким образом, делаем вывод, что эти связи ковалентные полярные. Ответом на задание будут пункты 1 и 5.
В условии задания словосочетание «ковалентная полярная связь» тоже может отсутствовать. Вместо него может встретиться такая формулировка: укажите соединения, которые содержат такую же связь, как в молекуле хлороводорода. Здесь следует сразу понять, что речь идет о ковалентной полярной связи. Вместо хлороводорода могут быть предложены другие соединения – вода, бромоводород, сероводород и т.п.
Иногда в задании 4 нужно выбрать соединения с учетом несколько условий. Посмотрим на пример 4.
Задание 4.
Из предложенного перечня выберите два соединения, которые имеют ковалентные полярные связи, но не имеют ионных.
1) CH3COOH
2) Na2SO4
3) H2O
4) HCOOK
5) NH4Br
Связи во всех предложенных соединениях изображены на рисунке ниже.
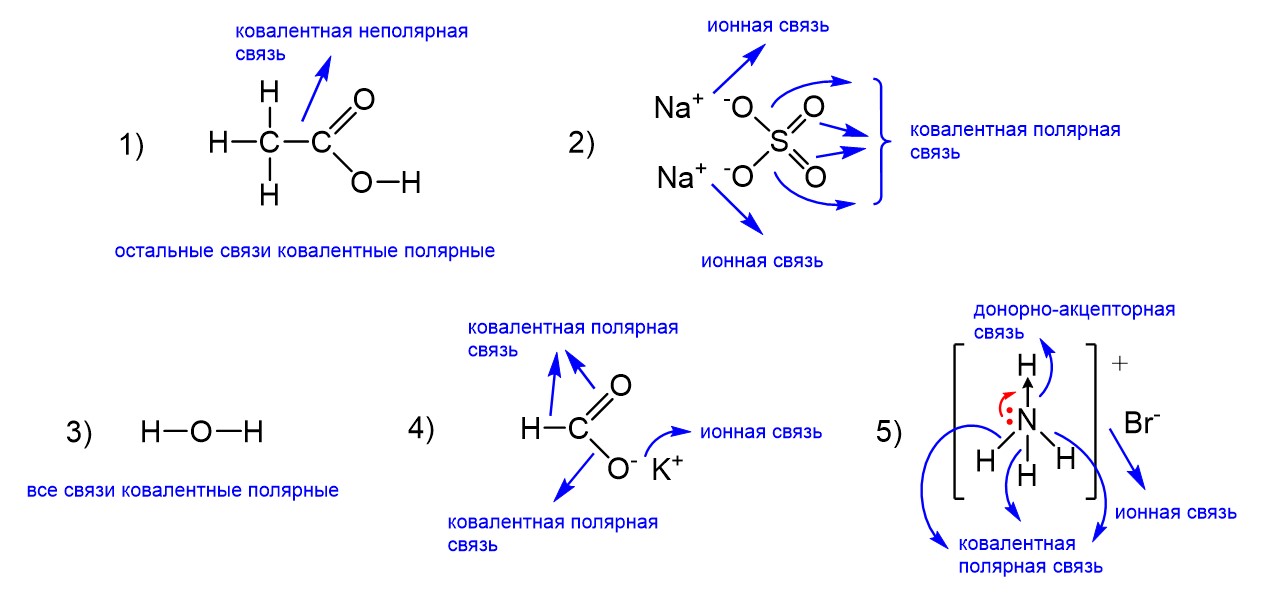
Первое соединение – это уксусная кислота. В ее молекуле почти все связи образованы разными элементами (C-H, С-О, C=O, O-H) и есть одна неполярная связь (C-C). Это кислота, а не соль, значит, ионных связей нет. Поэтому уксусная кислота подходит нам в качестве ответа. Второе соединение, сульфат натрия Na2SO4, уже является солью. Поэтому несмотря на то что ковалентные полярные связи в ней есть, наличие ионной связи между катионами Na+ и анионом SO42- не позволяет выбрать этот ответ. Третьим пунктом идет вода, в ней обе связи являются ковалентными полярными, а ионных связей нет. Нам подходит. Следующее соединение снова соль, это формиат калия HCOOK. Здесь все так же, как и в случае сульфата натрия. Ковалентные полярные связи есть, но, поскольку перед нам соль, ионная связь тоже присутствует. Не годится. Наконец, последнее соединение тоже соль, значит, снова есть ионная связь. В бромиде аммония появляется помимо ковалентной полярной также донорно-акцепторная связь, о чем мы как раз поговорим ниже. Ответ – пункты 1 и 3.
3. Выбор соединений с донорно-акцепторной связью.
Задание 5.
Из предложенного перечня выберите два соединения, которые имеют донорно-акцепторную связь.
1) HNO3
2) KCl
3) NH4Cl
4) H2SO4
5) O2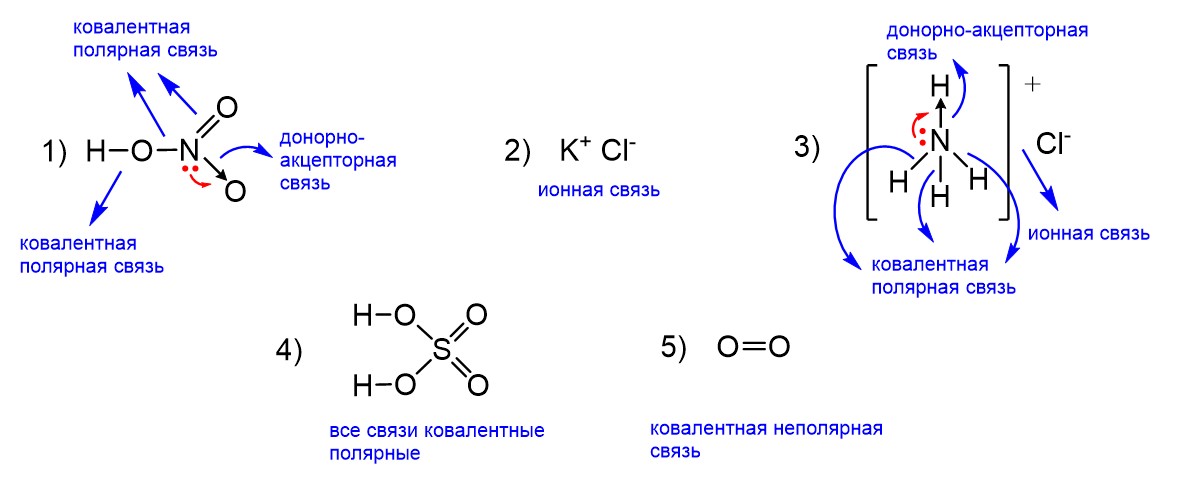
Донорно-акцепторная связь возникает тогда, когда в образовании химической связи участвуют электроны только одного атома. Иными словами, если в молекуле АВ связь А-В образована парой электронов только атома А или только атома В, то это донорно-акцепторная связь. Если она образована и электроном атома А, и электроном атома В, то мы имеем дело с обычной ковалентной полярной связью. Конечно, сформулировать случаи, когда именно возникает донорно-акцепторная связь, было бы весьма непросто. К счастью, это и не требуется. Достаточно просто запомнить вещества, где такая связь есть, тем более что их немного. Это соли аммония (NH4Cl, NH4Br, NH4I и др.), угарный газ (СО), озон (O3), азотная кислота (HNO3) и нитраты (KNO3, NaNO3 и др.). Также следует включить в этот ряд катион гидроксония (H3O+) и органические производные солей аммония (соли метиламмония, диметиламмония, этиламмония и др.)
Исходя из этого, ответом в нашем задании будут соединения 1 и 3. Ниже на рисунке показаны все связи во всех предложенных соединениях. В азотной кислоте одна из связей N-O как раз образована по донорно-акцепторному механизму. Это означает, что неподеленная пара электронов атома азота, находящаяся на одной орбитали, целиком «потратилась» на образование связи с атомом кислорода без участия электронов последнего. Такую же картину мы видим в случае катиона аммония в соли NH4Cl. Три связи N-H в катионе NH4+ являются ковалентными полярными, то есть их образуют и электроны азота, и электроны водорода. А вот четвертая – донорно-акцепторная. Здесь снова пара электронов азота «потратилась» на образование связи N-H.
Остальные соединения нам не подходят. KCl – это соль с ионной, как и у всех солей, связью. Но донорно-акцепторной связи здесь нет, поэтому что это не соль аммония и не нитрат. Отметим, что в солях аммония и нитратах ионная связь тоже есть, то есть наличие донорно-акцепторной связи не исключает наличия других типов связи. В серной кислоте H2SO4 все связи ковалентные полярные, а в молекуле кислорода O2 есть только одна ковалентная неполярная связь.
Посмотрим на второе задание такого же типа.
Задание 6.
Из предложенного перечня выберите два соединения, которые имеют донорно-акцепторную связь.
1) K3PO4
2) O3
3) HCl
4) CO
5) Br2
Все связи во всех предложенных соединениях показаны на рисунке ниже. 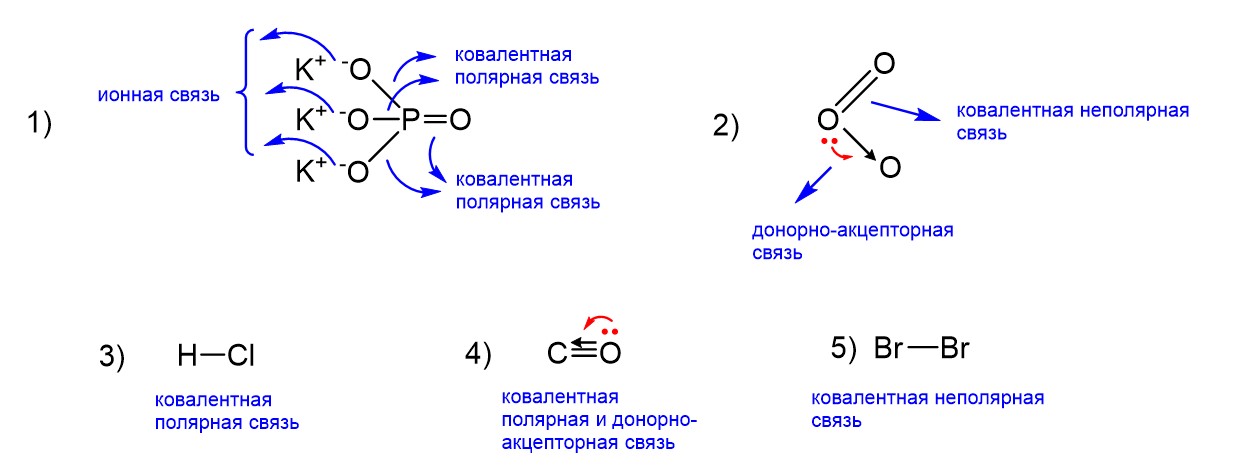
Пойдем по порядку. K3PO4 – это фосфат калия, то есть соль. Внутри фосфат-иона PO43- есть ковалентные полярные связи, а связь между ним и катионом калия K+ является ионной. Мы помним, что во всех солях есть ионная связь. Однако наша соль не является ни солью аммония, ни нитратом, поэтому донорно-акцепторной связи здесь нет.
Далее идет озон О3. Он входит в группу соединений с донорно-акцепторной связью, которую мы приводили выше. На рисунке показано, что один атом кислорода в этой молекуле образует связь с двумя другими. Одна из этих связей ковалентная неполярная, а другая донорно-акцепторная. Следует сказать, что донорно-акцепторная связь в этом случае превращается в двойную неполярную, а двойная неполярная превращается в донорно-акцепторную, причем такие превращения происходят очень быстро. Эти превращающиеся друг в друга структуры называются резонансными, и в итоге это приводит к формированию некой усредненной структуры с так называемыми «полуторными связями», как показано ниже. 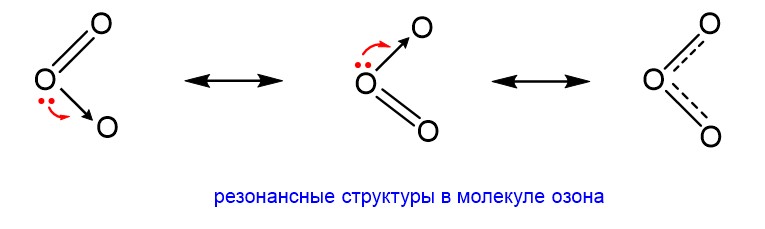
Но в рамках нашего задания достаточно знать, что донорно-акцепторная связь в этой молекуле есть.
Следующим идет HCl. Если это газ хлороводород (а по умолчанию мы считаем именно так), то между атомами водорода и хлора связь будет ковалентная полярная. Если бы был дан раствор HCl в воде, тогда эта связь вследствие действия воды стала бы ионной. В любом случае донорно-акцепторной связи здесь нет, HCl не входит в указанную выше группу соединений с этой связью.
А вот в молекуле угарного газа СО донорно-акцепторная связь есть. Казалось бы, атомы С и О образуют обычную двойную ковалентную полярную связь, однако в действительности связь между этими атомами не двойная, а тройная. Третья связь образована как раз по донорно-акцепторному механизму за счет пары электронов кислорода.
Наконец в молекуле простого вещества брома есть только неполярная ковалентная связь, а донорно-акцепторная отсутствует.
4. Выбор соединений с водородной связью.
Подробнее о водородной связи можно прочитать в этой статье. Здесь я кратко повторю, когда она возникает.
Водородная связь возникает в веществах молекулярного строения, имеющих ковалентные полярные связи H-F, H-O и H-N.
Можно, конечно, каждый раз проверять соединение на соответствие этим правилам, но гораздо проще запомнить соединения, в которых возникает водородная связь, потому что их не так много. Это вода H2O, аммиак NH3, фтороводородная кислота HF, спирты и карбоновые кислоты. Часто ошибочно полагают, что она образуется в альдегидах и молекулярном водороде H2. Нет, в альдегидах и Н2 ее нет. Посмотрим решение такого типа заданий на примерах.
Задание 7.
Из предложенного перечня выберите два соединения, которые образуют водородную связь.
1) H2O
2) HCHO
3) HCl
4) CH4
5) CH3COOH
Исходя из вышесказанного, можно заключить, что водородная связь образуется в воде и уксусной кислоте. И то, и другое – это молекулы, в которых есть ковалентные полярные связи О-Н. Формальдегид HCHO не подходит, потому что в его молекуле связь С=O, а не О-Н. Хлороводород не подходит, потому что здесь связь H-Cl, с хлором водородная связь не образуется (или, лучше сказать, она очень слабая). Те же рассуждения применимы к метану, потому что в его молекуле связь C-H, а не F-H, О-Н или N-H. В итоге получаем ответ: 1, 5.
Задание 8.
Из предложенного перечня выберите два соединения, которые не образуют водородную связь.
1) H2
2) C3H7OH
3) HF
4) NH3
5) NaH
Молекулярный водород водородную связь не образует, об этом мы говорили выше. Вторым пунктом идет пропанол, то есть спирт – вещество молекулярного строения с полярной связью О-Н. Здесь водородная связь есть. Далее в HF и NH3 тоже есть водородная связь, поскольку в них мы видим полярные связи H-F и N-H. Наконец, гидрид натрия NaH – это вообще ионное, а не молекулярное соединение, поэтому требования к образованию водородной связи здесь не выполняются. Ответ: 1, 5.
5. Задания на типы кристаллических решеток.
Тип кристаллической решетки, которую образует соединение в твердой фазе, напрямую зависит от типа химических связей, которые связывают атомы в молекулы или формульные единицы. Если в соединении есть ионная связь, то кристаллическая решетка будет ионной. Ионные соединения мы уже называли, это оксиды и гидроксиды металлов, а также все соли. Если соединение представляет собой молекулу, то кристаллическая решетка будет молекулярной. К этой группе относятся минеральные кислоты, вода, неметаллы, оксиды неметаллов и все органические соединения (кроме солей карбоновых кислот и солей спиртов). Если соединение не образуется молекул, а связь между атомами ковалентная, то кристаллическая решетка будет атомной. Для этого случая достаточно запомнить небольшой ряд веществ:
1) графит, алмаз (C)
2) кремний (Si)
3) кварц, кремнезем, речной песок или оксид кремния (IV) (SiO2)
4) карбид кремния (SiC)
Наконец, если дается металл, то у него решетка металлическая.
Теперь можно посмотреть на примеры заданий.
Задание 9.
Из предложенного перечня выберите два соединения с молекулярной кристаллической решеткой.
1) H2
2) (NH4)2HPO4
3) CH3Cl
4) Si
5) CH3COONa
Водород – это неметалл, он имеет молекулярное строение и, следовательно, молекулярную кристаллическую решетку. Подходит. Вторым пунктом идет соль гидрофосфат аммония. Все соли являются ионными соединениями, решетка тоже будет ионной. Третье соединение – это органическое вещество хлорметан. Все органические вещества, если они не соли, имеют молекулярное строение и молекулярную кристаллическую решетку. Тоже подходит. Кремний, идущий далее, как мы указывали выше, имеет атомную кристаллическую решетку. Наконец, последнее вещество тоже органическое, но на этот раз у нас соль карбоновой (уксусной) кислоты, а значит, решетка будет ионной. Ответ: 1, 3.
Задание 10.
Из предложенного перечня выберите два соединения с ионной кристаллической решеткой.
1) H2О
2) CsCl
3) SiC
4) C3H7OK
5) CCl4
Вода имеет молекулярное строение, поэтому кристаллическая решетка у нее молекулярная. Далее идет хлорид цезия CsCl, представляющий собой соль. Помним, что все соли имеют ионное строение и, следовательно, ионную кристаллическую решетку. Нам подходит. Третьим пунктом идет карбид кремния SiC. Мы его указывали в качестве примера соединения с атомной кристаллической решеткой, то есть не годится. Следующее вещество – это калиевая соль пропилового спирта, то есть пропилат калия C3H7OK. Связь металл-кислород является ионной, поэтому перед нами ионное соединение с ионной кристаллической решеткой. Наконец, четыреххлористый углерод CCl4 имеет молекулярное строение, потому что связь C-Cl недостаточно полярна, чтобы стать ионной. Решетка будет молекулярной. Итак, ответ: 2, 4.
Поскольку тип кристаллической решетки отражает физические свойства вещества, иногда вопрос может касаться не типа решетки непосредственно, а температур кипения или плавления соединений. Здесь нужно просто запомнить, что соединения с атомной или ионной кристаллической решеткой имеют относительно высокие температуры плавления и кипения, тогда как у соединений с молекулярной решеткой температуры плавления и кипения относительно низкие. Приведем пример.
Задание 11.
Из приведенных соединений укажите два, которые имеют низкие температуры кипения.
1) K3PO4
2) SiO2
3) H2O
4) алмаз
5) СH3COOH
Первое соединение – это фосфат калия K3PO4, то есть соль с ионной кристаллической решеткой. Такие вещества, как мы только что сказали, имеют высокие температуры плавления и кипения. Не годится. Следующим идет оксид кремния SiO2. Кристаллическая решетка у него атомная, значит, температура кипения снова будет высокой. Снова не годится. А вот у воды, имеющей молекулярное строение, температура кипения низкая - всего 100°С. Это действительно немного, учитывая, что температура плавления (даже не кипения) многих металлов для сравнения больше 1000°С. Идущий далее алмаз снова имеет атомную решетку и высокую температуру кипения. Что касается уксусной кислоты CH3COOH, то у нее молекулярное строение и низкая температура кипения (немногим больше, чем у воды). Итак, под ответ нам подходят соединения с молекулярной решеткой. Получим: 3, 5.
Итак, мы разобрали самые типичные примеры задания 4, которые могут встретиться в ЕГЭ по химии.
Хотите хорошо подготовиться к ЕГЭ по английскому или химии или изучать английский для себя? Запишитесь на занятия к автору сайта.
Занятия проходят онлайн, в удобном формате, в подходящее для Вас время.


