Ковалентная связь, электроотрицательность и степень окисления в ЕГЭ по химии
Прежде чем начать разговор о химических связях, будет полезно вспомнить, что изучает наука химия. Она, конечно, изучает строение и свойства веществ, но это верно и для физики. Самое «специфическое», что изучает химия и только химия, - это превращения веществ. Поэтому химическим процессом мы называем только тот, при котором одни вещества превращаются в другие. Например, кипение воды – это физический, а не химический процесс, потому что молекула воды в его результате остается молекулой воды, и новых веществ не образуется. Бывает еще большая группа ядерных превращений, когда разные химические элементы превращаются друг в друга. Это тоже не химия. Наука, изучающая такие процессы, называется ядерной физикой. Иными словами, при химическом процессе элементы остаются неизменными, но меняется порядок их соединения друг с другом. Вот здесь и возникает понятие химической связи.
Химическая связь – это сила, которая связывает атомы химических элементов в пространстве.
Теперь мы можем дать более точное и современное определение понятию химического процесса.
Химический процесс – это процесс, при котором происходит разрушение или образование химических связей.
Действительно, чтобы изменить порядок соединения химических элементов, нужно либо разорвать уже существующую химическую связь в веществе, либо образовать новую.
В курсе ЕГЭ мы считаем, что ядро любого атома состоит из протонов и/или нейтронов, а вокруг него располагаются оболочки с электронами. В действительности, конечно, все гораздо сложнее и элементарные частицы можно еще «расщепить», но это выходит за пределы школьной программы. Именно электроны, находящиеся на оболочках и удаленные от ядра на некоторое расстояние, участвуют в образовании всех типов химической связи. Протоны и нейтроны, находящиеся в ядре, к химической связи не имеют никакого отношения.
В курсе ЕГЭ необходимо знать три типа внутримолекулярной химической связи – ковалентную, ионную и донорно-акцепторную. Также необходимо иметь общее понятие о металлической и водородной связях. Про водородную связь можно прочитать здесь, а в данном материале мы поговорим о ковалентной химической связи.
Ковалентная химическая связь между атомами А и В возникает тогда, когда электроны атомов А и В становятся общими для этих атомов, связывая их ядра. Иными словами, происходит обобществление электронов А и В. Принципиально важно, чтобы и атом А, и атом В отдавали свои электроны в «общее пользование». Если этого не происходит, то связь нельзя назвать ковалентной. Такой случай мы рассмотрим в другой статье, когда будем говорить о донорно-акцепторной связи.
Удобно рассмотреть образование ковалентной связи на примере молекулы HCl. Эту молекулу образуются атомы H и Cl. До образования химической связи атом Н имеет 1 валентный электрон, а атом Cl имеет 7 таких электронов. Это связано с тем, что водород находится в главной подгруппе I группы, а хлор – в главной подгруппе VII группы. В таких случаях число валентных электронов равно номеру группы. Важно понимать, что в образовании химической связи принимают участие только валентные электроны. Собственно, само определение валентного электрона связано с возможностью образования им химической связи. Итак, на рисунке ниже слева показаны атомы H и Cl, точки вокруг них обозначают валентные электроны. Отметим, что всего у хлора 17 электронов, потому что его порядковый номер равен 17, но только 7 из них расположены на внешней третьей оболочке и являются валентными.
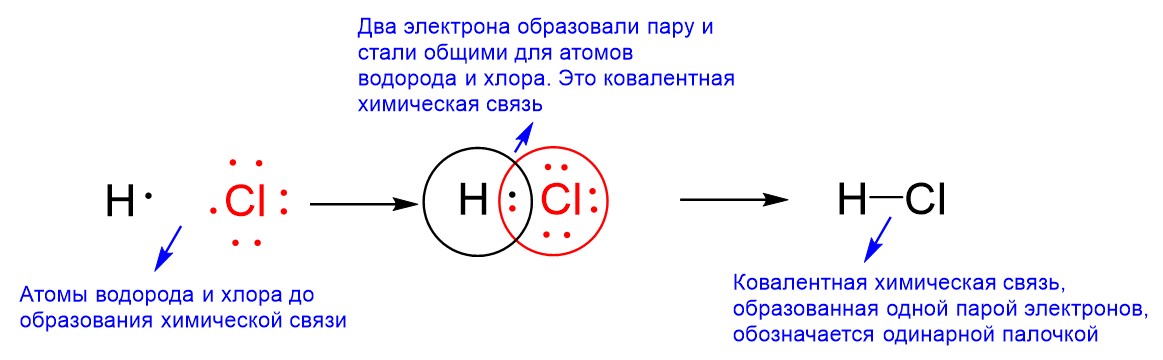
Далее происходит образование химической связи. Водород отдает свой единственный электрон в пространство между ядрами H и Cl, и хлор туда же отдает один из своих 7 электронов. Теперь эта пара электронов, размещенная между ядрами H и Cl, становится общей для обоих атомов. То есть эта пара входит в оболочку водорода, которая обозначена черной окружностью, и входит в оболочку хлора, которая обозначена красной окружностью. Иными словами, то, что пара электронов становится общей, означает, что она входит сразу в две оболочки обоих атомов. Это и есть ковалентная химическая связь.
Возникает вопрос: почему хлор передал только один электрон в «общее пользование», а не два или три? Это связано со следующим правилом.
При образовании ковалентной химической связи, атомы не всегда, но часто стремятся отдать или принять электроны таким образом, чтобы после образования связи в их оболочках число электронов стало равным числу электронов на оболочках ближайших благородных газов. При этом водород может отдавать единственный электрон, оставляя фактически голое ядро.
Здесь нужно определиться с понятиями «атом отдает электрон» и «атом принимает электрон». Для этого нужно ввести понятие «электроотрицательность» (ЭО).
Электроотрицательность (ЭО) – это способность атома притягивать к себе электроны другого атома в соединениях.
Электроотрицательностью обладают атомы всех элементов, вопрос только в том, высокая у нее величина или низкая. ЭО элементов растет направо по периоду и вверх по группе. Это означает, что максимальная ее величина будет у фтора, а минимальная – у цезия (потому что франций радиоактивен). Поскольку в школьном курсе мы считаем, что благородные газы не образуют химических соединений (хотя это не так, потому что существуют, например, фториды и оксиды ксенона), вопрос электроотрицательности применительно к элементам VIII группы мы не рассматриваем. Есть разные подходы к расчету электроотрицательностей, чаще всего даются таблицы этих величин по методу Полинга. Если посмотреть на такую таблицу в справочной литературе, то мы увидим, что у фтора значение 4,0, у кислорода 3,4, у хлора 3,2, у азота 3,0, а у щелочных металлов не превышает 1,0. Заучивать точные значения ЭО для всех элементов нет необходимости, главное знать, у какого из элементов, образующих связь A-B, она выше. А для этого нужно просто помнить закономерности изменения ЭО по группе и периоду.
Теперь мы можем объяснить, почему в молекуле хлороводорода только одна общая пара электронов, а не две или три. Как и атомы любых элементов, атомы водорода и хлора обладают некоторой величиной электроотрицательности. Но нам важны не абсолютные значения этих величин, а относительные. Иными словами, нужно знать, у какого атома ЭО выше. На первом этапе можно смотреть в справочнике, но со временем ЭО для основных элементов легко запоминаются, а значения для более редких элементов выводятся из их положения в Периодической таблице.
Итак, из справочных данных следует, что у водорода величина ЭО составляет 2,2, а у хлора 3,2. Чем выше величина ЭО у атома, тем сильнее этот атом тянет на себя электроны второго атома, с которым образует химическую связь. Собственно, общие электроны связи A-B тянет на себя именно тот атом, у которого ЭО выше. Поскольку у хлора ЭО выше, чем у водорода, то атом хлора будет тянуть на себя электрон водорода, а с ним и общую пару электронов. Теперь мы можем понять, почему общая пара электронов только одна. У хлора 7 электронов на внешней оболочке и до конфигурации ближайшего благородного газа неона ему не хватает одного электрона. Именно его он берет у водорода. А водород, с свою очередь, тоже может отдать только один электрон, поскольку только один электрон и имеет. Отдав его, он оголит ядро, что мы пояснили в правиле выше. Химические соединения удобно изображать на так называемых структурных формулах, в них одна общая электронная пара обозначается одинарной палочкой. На рисунке выше справа такая структурная формула показана для молекулы хлороводорода H-Cl.
Когда мы говорим о ковалентной химической связи, то вполне допустимо говорить об общих парах электронах. Именно такие представления даются в школьном курсе химии за 8 класс. Однако в действительности они требуют уточнения. Дело в том, что электроны не располагаются в какой-то конкретной точке пространства. Если взять атом водорода, то его единственный электрон не летает по окружности вокруг ядра, а как бы «размазывается» по этой окружности. Он присутствует одновременно в любой точке этой окружности, вопрос лишь в том, с какой вероятностью его можно найти в той или иной точке. Поэтому в химии говорят не о летающих по некой траектории электронах, а об электронных облаках, то есть областях пространства, по которым «размазаны» электроны. Такие области пространства называются орбиталями. Так вот ковалентная химическая связь образована не столько общими электронами, размещенными в пространстве между ядрами атомов, сколько перекрыванием электронных облаков или орбиталей этих атомов. В участке пространства между ядрами, где резко повышается вероятность найти сразу два электрона, и возникает ковалентная химическая связь. А возникает она там, где перекрываются орбитали. Впрочем, как уже говорилось, в курсе ЕГЭ вполне правомерно говорить об общих электронах.
Разница электроотрицательностей атомов H и Сl приводит к тому, что хлор сильнее тянет общую электронную пару к себе, то есть она локализуется ближе к атому хлора. Или, если говорить современным научным языком, то область перекрывания электронных облаков (орбиталей) атомов H и Cl – а именно эта область и есть химическая связь – пространственно локализуется ближе к атому хлора. Но если упрощать, то можно сказать и так: общая пара электронов H и Сl смещается ближе к атому хлора.
У хлора до образования химической связи было 17 электронов, из которых 7 были валентными. Каждый электрон имеет заряд -1, поэтому заряд всей электронной оболочки равен -17, ведь всего электронов 17. В ядре атома хлора 17 протонов, потому что порядковый номер хлора в Периодической таблице равен 17. Каждый из этих протонов имеет заряд +1. Тогда заряд всего ядра равен +17. В итоге заряд атома складывается из суммы зарядов оболочки и ядра, и тогда мы получим -17 + 17 = 0. То есть заряд атома хлора равен 0. Надо отметить, что это справедливо для любого атома. Атомы всех элементов в изолированном состоянии электронейтральны, то есть имеют заряд 0.
Теперь посмотрим, что происходит с атомом хлора после образования химической связи. Хлор имел свои 17 электронов, а теперь к нему приблизился электрон от атома водорода. Этот новый электрон также несет заряд -1, значит, теперь к нулевому заряду хлора следует прибавить заряд -1. Тогда мы получим у хлора заряд: 0 + (-1) = -1. Фактически это и есть степень окисления. А водород, чей заряд до образования связи с хлором был тоже равен 0, свой единственный электрон потерял, потому что этот электрон частично покинул оболочку водорода и вошел в оболочку хлора. Потеря электрона влечет потерю заряда -1 и тогда мы получим для заряда водорода следующее выражение: 0 – (-1) = +1. У водорода возникает заряд +1, и он тоже называется степенью окисления.
Таким образом, для понятия степени окисления можно дать следующее определение:
Степень окисления – это заряд, который возникает на атомах после образования ими химической связи.
На рисунке ниже показано возникновение степеней окисления в молекуле HCl.
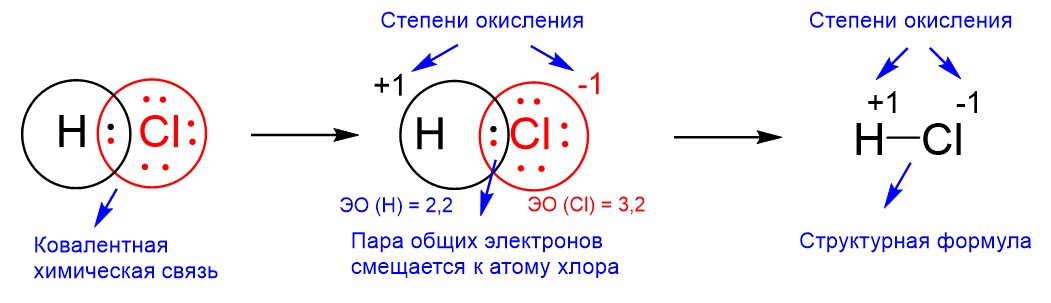
Следует дать небольшое пояснение. Степени окисления +1 и -1, которые в молекуле H-Cl возникают соответственно на атомах H и Сl, отражают не полные, а частичные заряды. Чтобы заряд был полным, необходимо, чтобы электрон полностью покинул оболочку водорода и так же полностью перешел на оболочку хлора. Тогда электрон водорода принес бы хлору свой полный заряд -1. Такое действительно возможно, но только в случае ионной связи. Когда связь ковалентная, электрон никогда не покидает оболочку одного атома и не переходит на оболочку другого атома полностью. На рисунке выше это было показано. Общая пара электронов входит как в окружность водорода, так и в окружность хлора (окружности обозначают электронные оболочки атомов). Поэтому общая пара электронов только приближается к атому хлора, но электрон водорода не покидает полностью своей оболочки. В результате реальные заряды на атомах H и Cl равны не +1 и -1, а +0,18 и -0,18. Поскольку определение точных реальных зарядов представляет собой отдельную физико-химическую задачу, иногда частичные заряды без указания конкретной величины обозначают греческой буквой δ («дельта») со знаком заряда, то есть δ+ и δ-. Допустимо также обозначать смещение общей пары электронов стрелкой.
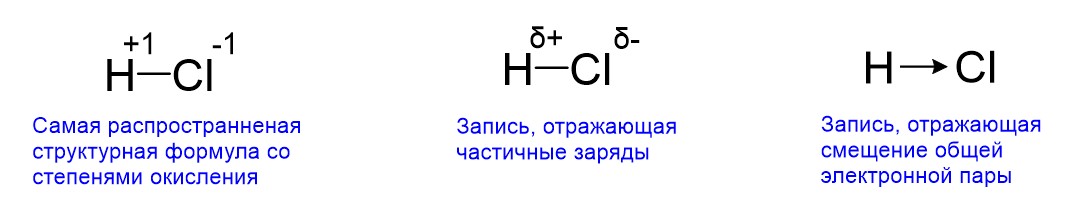
Самая распространенная запись – это структурные формулы. В них общие пары электронов ковалентной связи обозначаются палочками. Также в них возможно отражение степеней окисления. Хотя последние часто выражают частичный заряд, они расставляются в предположении, что электроны полностью переходят с одного атома на другой и возникают полные заряды. Отметим также, что в ЕГЭ вопросов о реальных зарядах атомов после образования химической связи не бывает.
Если после образования ковалентной связи на атомах образуются положительные и отрицательные степени окисления, то такая ковалентная связь называется полярной. В ЕГЭ есть задания на выбор веществ с полярной ковалентной связью. Эти случаи легко распознать:
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью, то есть между разными атомами.
Любые два разных атома будут иметь разную ЭО, поэтому между ними всегда будет полярная связь. Важно, однако, установить, чтобы связь была именно ковалентная. Иногда разница в ЭО между атомами A и B настолько высока, что полярная ковалентная связь становится «настолько полярной», что электроны полностью переходят с одного атома на другой. Такой случай рассматривается отдельно и имеет собственное название – ионная связь. Приблизительное правило, позволяющее отличить ионную связь от ковалентной полярной, звучит так:
Если разница ЭО между атомами А и В превышает 1,7 пунктов, то связь А-В из ковалентной полярной превращается в ионную.
В качестве примера можно привести оксиды металлов I группы. Если у натрия ЭО равна 0,9, а у кислорода 3,4, то разница составит 2,5 пунктов. Это больше 1,7, поэтому Na2O имеет не ковалентную полярную, а ионную связь. На практике заучивать значения ЭО для всех элементов все равно не потребуется, потому что ионную связь образуют только определенные классы соединений. Достаточно их просто выучить. Это мы рассмотрим в отдельной статье.
Теперь можно рассмотреть образование ковалентной связи между атомами водорода в молекуле H2. Каждый из двух атомов водорода до образования химической связи имеет один валентный электрон, поскольку водород – это первый элемент Периодической таблицы и находится он в первой группе и в первом периоде. При образовании химической связи эти два валентных электрона от двух атомов водорода становятся общими и локализуются между ядрами атомов водорода. Снова образуется ковалентная химическая связь. Но теперь ее создают два одинаковых атома с соответственно одинаковыми ЭО. Если ЭО двух атомов одинаковы, то они с одинаковой силой тянут на себя общую электронную пару и никто из них не перетягивает ее сильнее. Значит, общая пара электронов не приближается ни к одному из них и частичные заряды на атомах возникнуть не могут. Получается, что заряд на обоих атомах водорода равен 0, как показано на рисунке ниже.
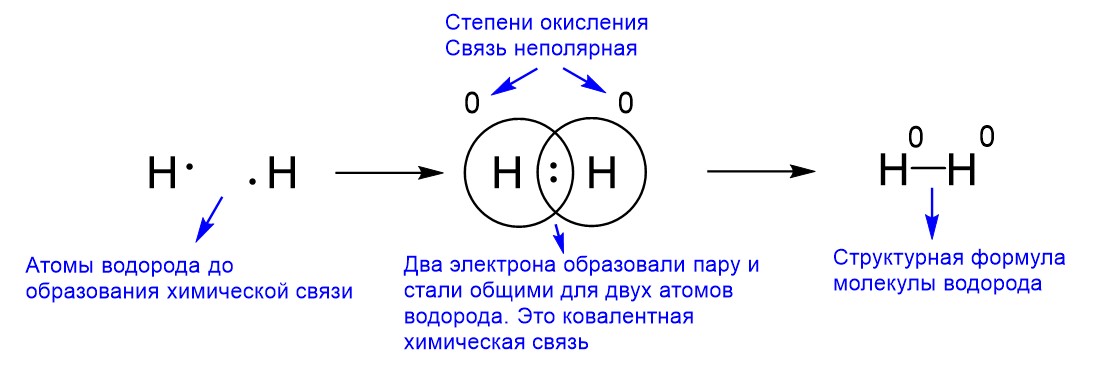 Такая ситуация имеет свое название – неполярная ковалентная связь, - для которой мы теперь можем дать определение.
Такая ситуация имеет свое название – неполярная ковалентная связь, - для которой мы теперь можем дать определение.
Неполярная ковалентная связь возникает между атомами с одинаковой электроотрицательностью, то есть между одинаковыми атомами.
Можно привести несколько примеров веществ с ковалентной неполярной связью: Cl2, Br2, I2, O2, N2, S8, P4. Во всех этих случаях ковалентная связь образуется между одинаковыми атомами.
В примерах выше мы рассматривали случай обобществления только одной пары электронов, которую обозначали одинарной палочкой. Тем не менее есть множество соединений, в которых общими становятся две и три пары электронов. Посмотрим, например, на молекулу СО2. 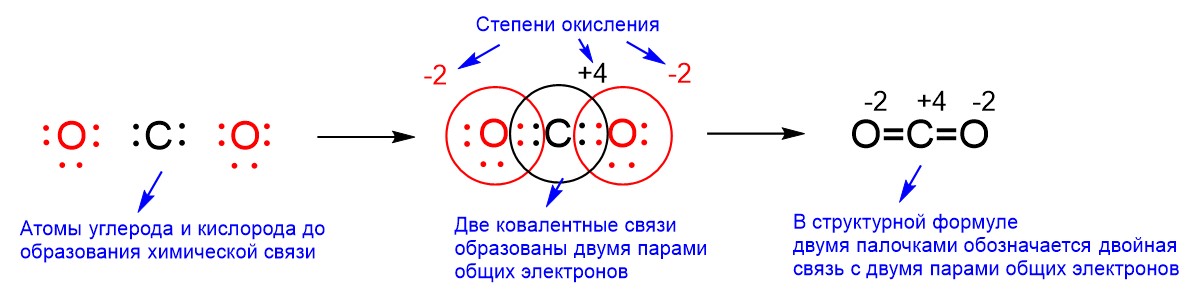
Углерод находится в четвертой группе, поэтому его атом имеет четыре валентных электрона. Только они могут принимать участие в образовании химической связи. В свою очередь, у каждого из двух атомов кислорода по шесть электронов на внешней оболочке, так как кислород находится в шестой группе. ЭО кислорода выше, чем ЭО углерода, так как кислород правее по периоду, а направо по периоду ЭО возрастает. Поэтому кислород будет оттягивать на себя общие электронные пары и соответственно электроны углерода. Мы говорили о том, что при образовании химической связи атомы, отдавая или принимая электроны, не всегда, но часто стремятся достроить электронную оболочку до конфигурации ближайшего благородного газа. Кислороду до электронной оболочки ближайшего благородного газа неона необходимо взять два электрона, а углероду необходимо отдать четыре электрона, чтобы оболочка достроилась до конфигурации гелия. Если кислороду нужно взять два электрона, а углероду отдать четыре, то нам необходимы два атома кислорода, чтобы забрать у углерода два раза по два электрона. Отсюда и формула этого соединения с двумя атомами кислорода - СО2. Получается, что углерод образует по одной связи с каждым из двух атомов кислорода. В каждой такой связи участвует по четыре электрона, то есть по две пары. В таком случае в структурной формуле две пары общих электронов обозначаются двойной палочкой: О=С=О. Обе связи являются полярными, потому что углерод и кислород являются разными атомами с разной ЭО. Если связи полярные, то на атомах должны возникнуть отличные от 0 степени окисления. Каждый из двух атомов кислорода приблизил себе два электрона углерода, поэтому у них возникает степень окисления -2. Углерод отдалил от себя суммарно четыре электрона, поэтому у него степень окисления +4.
Пример химической связи, образованной тремя общими парами электронов, можно найти в молекуле азота N2, как показано на рисунке ниже.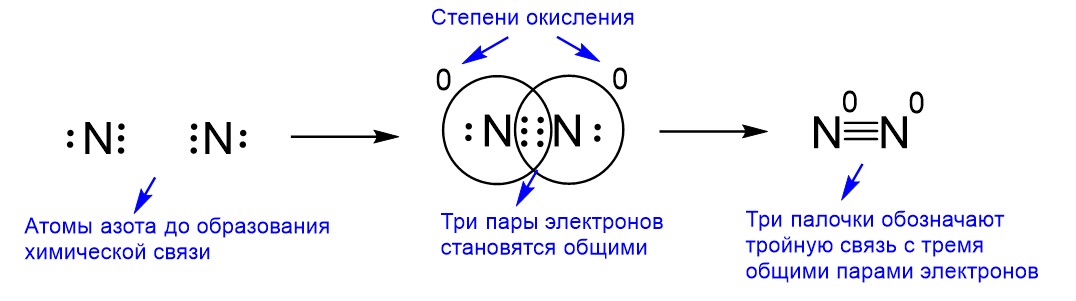
До образования химической связи атомы азота имеют по пять валентных электронов, потому что элемент азот находится в пятой группе. Для того, чтобы электронов стало восемь и электронная конфигурация совпала с конфигурацией ближайшего благородного газа неона, азоту нужно еще три электрона. Поэтому при образовании химической связи атомы азота передают друг другу «в общее пользование» по три электрона. Так у них становятся общими три пары электронов. На структурной формуле такую ковалентную связь изображают тремя палочками N≡N. Эта связь образована одинаковыми атомами, поэтому она неполярная и степени окисления атомов азота равны 0.
Может возникнуть вопрос: а бывают ли четверные связи? Да, бывают, но образовывать их могут только некоторые переходные d-элементы, у которых много валентных электронов. Например, ацетат хрома (II) содержит в своей структуре четверную связь между атомами хрома. Но знание четверных связей выходит за рамки программы ЕГЭ и на экзамене такого вопроса точно не будет.
В этом материале я разобрал теоретические вопросы, связанные с образованием ковалентной химической связи и ее типами, а также с понятиями электроотрицательности и степени окисления. Тому, как практически решать задания ЕГЭ на виды химических связей, я посвящу отдельный материал.
Хотите хорошо подготовиться к ЕГЭ по английскому или химии или изучать английский для себя? Запишитесь на занятия к автору сайта.
Занятия проходят онлайн, в удобном формате, в подходящее для Вас время.


