Чем отличаются кислотные и окислительные свойства?
Кислоты могут иметь два важных химических свойства – кислотные и окислительные. Поскольку оба термина содержат корень, связанный со словом «кислота», это часто вызывает путаницу у сдающих ЕГЭ по химии. Существует ошибочное представление о том, что кислотные свойства связаны с окислительными и что, например, сильные кислоты обязательно являются сильными окислителями. В этом материале мы подробно разберем отличия в этих свойствах.
Содержание
1. Кислотные свойства.
2. Окислительные свойства.
3. Связь кислотных и окислительных свойств.
1. Кислотные свойства.
Любую кислоту можно схематично представить как HX, где Н – водород, а X – кислотный остаток. При этом лучше писать водород в виде катиона Н+, а кислотный остаток в виде аниона X-. HX – это одноосновная кислота, то есть такая, в которой только один водород способен заменяться на катион, например, металла. Продукт такой замены будет называться солью. Бывают также двухосновные, трехосновные и даже многоосновные кислоты, в них соответственно два, три и большее число атомов водорода способны обмениваться на катион. Поэтому двухосновную кислоту можно записать как H2X (Н+ - водород, а X2- - кислотный остаток), а трехосновную как H3X (H+ - водород, а X3- - кислотный остаток).
Почему, обсуждая кислоты, мы вообще завели речь об ионах Н+ и анионах X-, X2- и X3-? Потому что в водном растворе кислоты подвергаются процессу электролитической диссоциации, то есть распаду на ионы. Поэтому при растворении кислоты в воде мы вполне может увидеть результат такого распада, то есть сами ионы. Процесс, если брать одноосновную кислоту, описываются следующим уравнением:
HX ⇆ H+ + X-
Но есть важный момент. Дело в том, что этот процесс распада кислоты на ионы может протекать по-разному. Бывает, что HX хорошо распадается, и тогда мы видим много ионов H+ и X- и мало молекул нераспавшейся кислоты HX. И бывает наоборот, когда молекул нераспавшейся кислоты HX много, а ионов H+ и X- мало. Иными словами, процесс распада кислоты на ионы может протекать с разной глубиной. Вот именно с этим - и только с этим! – и связаны понятия «сильная кислота» и «слабая кислота». Сильная кислота – это такая, которая очень хорошо распадается на ионы, а слабая – это такая, которая распадается плохо.

В школьном курсе понятия сильной и слабой кислоты мы определяем оценочно. Но в действительности силу кислоты можно описать точным математическим выражением. Для этого следует ввести понятие константы диссоциации кислоты, которое обозначается как Ка и определяется как отношение произведений равновесных концентраций ионов после диссоциации к равновесной концентрации нераспавшейся кислоты в молекулярной форме.
HX ⇆ H+ + X-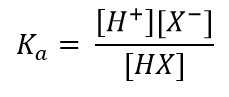
Здесь запись [H+], [X-] и [HX] означает равновесные концентрации соответствующих ионов и нераспавшейся кислоты. Понятно, что Ka пропорциональна концентрациям ионов и обратно пропорциональна концентрации кислоты. Поэтому чем сильнее кислота, тем лучше она распадается на ионы, тем выше концентрация этих ионов в растворе и тем выше значение Ка. Химики еще часто оперируют величиной, которая обозначается как рKa. Это отрицательный десятичный логарифм константы диссоциации, то есть:
pKa = -lgKa
Тогда понятно, что чем сильнее кислота, тем выше Ka и тем ниже pKa.
Для лучшего представления о порядках величин Ka и pKa можно привести три примера.
| HCl | H3PO4 | CH3COOH |
Ka | 1 ∙ 107 | 7,1 ∙ 10-3 * | 1,75 ∙ 10-5 |
pKa | -7 | 2,1 * | 4,75 |
Сила кислоты | сильная | средней силы | слабая |
*для диссоциации по первой ступени | |||
Соляная кислота HCl является очень сильной кислотой, фосфорная H3PO4 - кислотой средней силы и уксусная CH3COOH – слабой кислотой. Обратите внимание, что для фосфорной кислоты мы привели только первую ступень диссоциации, которая описывается уравнением:
H3PO4 ⇆ H+ + H2PO4-
Между тем фосфорная кислота является трехосновной, поэтому возможна дальнейшая диссоциации по второй и третьей ступеням:
H2PO4- ⇆ H+ + HPO42-
HPO4- ⇆ H+ + PO43-
Однако эти процессы протекают в гораздо меньшей степени, поэтому фактически сила фосфорной кислоты определяется первой ступенью диссоциации.
Ниже приводится таблица важнейших кислот, которые могут встретиться на ЕГЭ по химии, по силе.
Сильные | Средние по силе | Слабые |
HCl, HBr, HI, H2SO4, HNO3, HClO3, HClO4, HIO3 | H3PO4, H2SO3, HClO2, H3PO3 | HF, H2SiO3, H2CO3, H2S, CH3COOH, HClO |
Теперь мы можем сформулировать главный вывод:
Кислотные свойства связаны со способностью кислоты отдавать катион Н+ в результате электролитической диссоциации. Тем лучше кислота отдает катион Н+, тем она сильнее.
2. Окислительные свойства.
Если кислотные свойства кислоты связаны с ее способностью отдавать катион Н+, то окислительные к этому процессу не имеют никакого отношения. Быть окислителем – значит иметь способность забирать электроны у другого атома. Этот другой атом, который отдает электроны окислителю, будет соответственно называться восстановителем. Процессы можно описать следующим образом:
Окислитель: A + ne- = A-n
Восстановитель: B – ne- = B+n
Здесь схематично показано, что окислитель, то есть атом А, принял n электронов и понизил свою степень окисления до –n, а восстановитель, то есть атом B, отдал n электронов и поднял свою степень окисления до +n.
Во-первых, нужно понимать, что окислительные или восстановительные свойства в конечном счете связаны с конкретным атомом А или B. Поэтому, когда окислителем или восстановителем называют целую молекулу, под этим подразумевается, что в ее составе есть атом окислителя или восстановителя. Во-вторых, из указанной выше схемы может создаться впечатление, что A и B до приема или отдачи электронов обязательно имели степень окисления 0. Конечно, это не так. Их исходная степень окисления может разной, не только 0. В-третьих, число отданных или принятых электронов n тоже может быть разным: 1, 2, 3 и выше.
Окислительные свойства могут проявлять разные классы соединений, то есть не только кислоты. Но мы в данном материале рассматриваем только кислоты. Есть два важных понятия, применяемых к кислотам – это кислота-окислитель и кислота-неокислитель. Дадим им определения.
Если кислота участвует в ОВР и атомом-окислителем в ней является атом кислотного остатка, то такая кислота называется кислотой-окислителем.
Две самые главные кислоты-окислителя в курсе ЕГЭ по химии – это концентрированная серная кислота, а также азотная кислота любой концентрации. Приведем примеры.
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
Здесь атомом-окислителем выступает сера, которая меняет степень окисления с +6 в H2SO4 до +4 в SO2. Этот атом серы входит в состав кислотного остатка SO42-, следовательно, серная кислота является кислотой-окислителем.
Второй пример:
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
Здесь атомом-окислителем является азот, который меняет степень окисления с +5 в HNO3 до -3 в катионе аммония в NH4NO3. Этот атом азота входит в состав кислотного остатка NO3-, следовательно, азотная кислота является кислотой-окислителем.
Теперь определим, что такое кислота-неокислитель.
Если кислота участвует в ОВР и атомом-окислителем в ней является водород, то такая кислота называется кислотой-неокислителем.
Приведем примеры.
Zn + 2HCl = ZnCl2 + H2
Здесь хлор, образующий кислотный остаток, не поменял степень окисления сохранив ее -1. А вот водород поменял с +1 в HCl до 0 в H2. То есть реальным окислителем является водород, следовательно, HCl – кислота-неокислитель.
Второй пример.
Li + H2SO4 (разб.) = Li2SO4 + H2
Здесь сера, входящая в кислотный остаток SO42-, сохраняет степень окисления +6. А вот водород снова меняет ее с +1 в H2SO4 до 0 в H2. Следовательно, разбавленная серная кислота является кислотой-неокислителем. Напомним, что концентрированная серная кислота становится наоборот кислотой-окислителем.
Здесь требуется пояснить чуть подробнее. Кислоту, даже если в ней реальным окислителем выступает H+, все равно можно называть окислителем. Поэтому если при обсуждении конкретной ОВР нужно назвать окислитель и восстановитель, то мы, безусловно, назовем кислоту окислителем. Но с точки зрения классификации окислительных свойств кислот как класса соединений, кислота-неокислитель – это тип кислоты, в которой кислотный остаток не выступает реальным окислителем.
В качестве примеров кислот-неокислителей можно привести HCl, HBr, HI, H3PO4, H2S и другие. Здесь важное отметить следующее. Казалось бы, если атом неметалла в кислотном остатке находится в высокой степени окисления, он может ее понижать, то есть принимать чужие электроны, и соответственно быть окислителем. Тем не менее это не всегда так. H3PO4 (несмотря на высокую степень окисления фосфора +5), H2CO3 (несмотря на высокую степень окисления углерода +4) и H2SiO3 (несмотря на степень окисления кремния +4) не являются кислотами-окислителями.
Силу окислительной способности кислот-окислителей тоже можно точно выразить количественно. Для этого в электрохимии существует понятие стандартного электродного потенциала. Однако на этой теме мы останавливаться подробно не будем, потому что она не входит в программу ЕГЭ. Повторим главное:
Окислительные свойства кислот связаны исключительно с их способностью входящих в их состав атомов забирать электроны других атомов.
3. Связь кислотных и окислительных свойств.
Мы установили, что кислотные свойства связаны с отщеплением катиона Н+, а окислительные – с отнятием электронов у других атомов. То есть, как видно, это совершенно разные процессы. И действительно, связи между силой кислотных свойств и силой окислительных свойств нет никакой. Бывают сильные кислоты, которые проявляют слабые окислительные свойства (то есть окислителем может быть только Н+ в реакциях с активными металлами). И бывают слабые кислоты, которые являются сильными окислителями. Возможны вообще любые комбинации: сильная кислота/сильный окислитель, слабая кислота/слабый окислитель, сильная кислота/слабый окислитель и слабая кислота/сильный окислитель. Примеры таких кислот приведены в таблице ниже.
| Слабая кислота | Сильная кислота |
Сильный окислитель | HClO | HNO3 |
Слабый окислитель (за счет Н+) | H2S | H2SO4 (разб.) |
Поэтому не нужно смешивать кислотные и окислительные свойства, они никак не связаны.
Хотите хорошо подготовиться к ЕГЭ по английскому или химии или изучать английский для себя? Запишитесь на занятия к автору сайта.
Занятия проходят онлайн, в удобном формате, в подходящее для Вас время.


