Все способы получения солей в ЕГЭ по химии
Прежде чем обсуждать способны получения солей, необходимо вспомнить, что именно представляют собой соли. Можно дать два определения этому классу веществ:
1. Соль – это соединение ионного строения, содержащее катион металла или аммония и анион кислотного остатка.
2. Соль – это продукт замещения водорода в кислоте на металл или катион аммония.
Здесь следует сделать уточнение. В курсе ЕГЭ в качестве катионов солей действительно могут выступать только металлы и катион аммония. В некоторых заданиях, правда, еще могут встретиться производные катиона аммония, в которых один или несколько атомов водорода замещены на алкильные радикалы. Но на самом деле катионов существует гораздо больше, просто они выходят за рамки нашего рассмотрения.
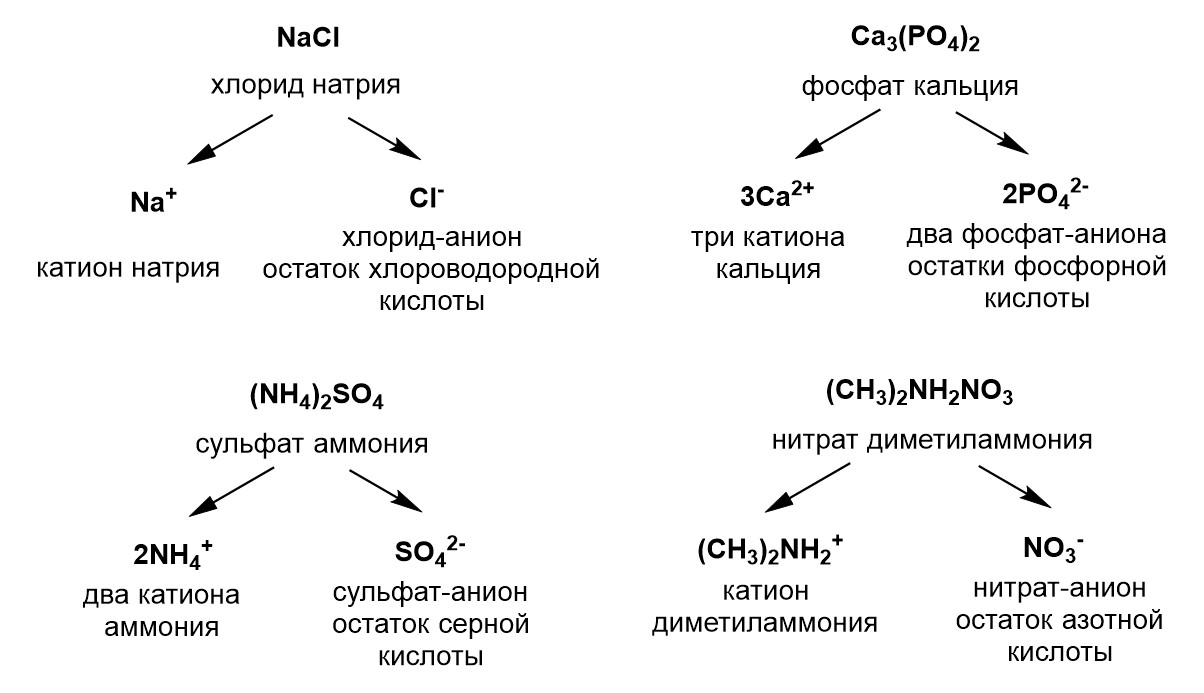
Приведем примеры солей. Например, это хлорид натрия NaCl. Если использовать первое определение соли, то эта соль как раз содержит катион Na+ и анион Cl-, который является остатком хлороводородной кислоты. Если использовать второе определение, то NaCl – это продукт замещения водорода в HCl на металл натрий. Второй пример соли - это фосфат кальция Ca3(PO4)2. В этой соли есть три катиона Ca2+ и два аниона PO43-, представляющие собой остаток ортофосфорной кислоты. В качестве примера с катионом аммония можно привести сульфат аммония (NH4)2SO4. Анион SO42- представляет собой кислотный остаток серной кислоты H2SO4. Наконец примером соли, содержащей производное катиона аммония с органическими радикалами, может послужить нитрат диметиламмония (CH3)2NH2NO3. Здесь катион получен замещением двух атомов водорода в катионе аммония на метильные радикалы СН3-, что можно схематично изобразить так: NH4+ → (CH3)2NH2+. Анионом в этом соли выступает остаток азотной кислоты – нитрат-анион NO3-. Все эти четыре примера солей с указанием катионов и анионов показаны на рисунке ниже.
Теоретически для образования соли можно взять любые катионы и анионы, но на практике не все соли устойчивы. Например, можно получить карбонат аммония (NH4)2CO3, но если его хранить в сухом виде в неплотно закрытой банке, он улетучится вследствие распада на аммиак, углекислый газ и воду. Не существуют солей CuI2 и FeI3, которые в момент образования, например, по реакции ионного обмена распадаются на CuI + I2 и FeI2 + I2. Некоторые соли не могут существовать в водном растворе вследствие сильного или даже необратимого гидролиза. Например, в водном растворе не бывает солей (NH4)3PO4, Al2S3, Cr2(SO3)3, Fe2(CO3)3 и ряда других. Поэтому не всегда можно получить соль, соединив произвольные катион и анион.
В этом материале мы поговорим о том, с помощью каких реакций можно получить соли. Классификацию эти реакций мы будем связывать с классами реагирующих веществ.
Содержание
1. Реакции металлов с неметаллами.
2. Реакции металлов с кислотами.
3. Реакции металлов с растворами солей.
4. Реакции между оксидами металлов и неметаллов.
5. Реакции между оксидами металлов и кислотами.
6. Реакции между оксидами неметаллов и щелочами.
7. Реакции между кислотами и щелочами.
8. Реакции между кислотами и солями.
9. Реакции между щелочами и солями.
10. Реакции между двумя солями.
11. Разложение солей.
1. Реакции металлов с неметаллами.
Многие неметаллы образуют бескислородные кислоты. Мы хорошо знаем примеры с серой и галогенами, которые образуют кислоты H2S, HF, HCl, HBr, HI. Но в действительности и другие гидриды неметаллов тоже являются кислотами, просто очень и очень слабыми, слабее по кислотным свойствам даже чем вода. Поэтому если NH3, PH3, CH4 и C2H2 считать кислотами, то их производные, в которых водород замещен на металл, можно в некотором смысле считать солями. Таковы соответственно нитриды, фосфиды и карбиды. Многие такие соли можно получить по реакции металла с соответствующим неметаллом. Например:
Zn + S → ZnS
2Fe + 3Cl2 → 2FeCl3
2Na + Br2 → 2NaBr
Некоторые из этих реакций требуют нагрева, а некоторые могут протекать уже при комнатной температуре. Нагрев, например, не требуется для реакции ртути и серы:
Hg + S → HgS
Нитриды, фосфиды и карбиды тоже можно получить по реакции простых веществ. Литий реагирует с азотом при комнатной температуре с образованием нитрида лития:
6Li + N2 → 2Li3N
Кальций реагирует с фосфором и углеродом с образованием соответственно фосфида и карбида:
3Ca + 2P → Ca3P2
Ca + 2C → CaC2
Карбид кальция, полученный в реакции выше, можно считать солью ацетилена, то есть это ацетиленид кальция. Однако не все металлы образуют ацетилениды. Алюминий с углеродом реагирует иначе:
4Al + 3C → Al4C3
Полученное соединение уже не является солью ацетилена, это соль метана, которую можно назвать метанидом. Тем не менее и ацетилениды, и метаниды объединены более общим названием «карбиды».
2. Реакции металлов с кислотами.
Все кислоты можно разделить на две большие группы – кислоты-окислители и кислоты-неокислители. В кислотах-окислителях реальным окислителем в ОВР является атом кислотного остатка, а в кислотах-неокислителях только атом водорода. Если металл взаимодействует с кислотой-неокислителем, то образуется соль этой кислоты и выделяется водород. Но чтобы такая реакция пошла, металл должен находиться в ряду активности до водорода, в противном случае он не сможет вытеснить водород из кислоты. Кислоты-неокислители - это H2S, HF, HCl, HBr, HI, H2SO4 (разбавленная), H3PO4. Ниже приведены типичные реакции:
Zn + 2HCl → ZnCl2 + H2↑
2K + 2HBr → 2KBr + H2↑
Fe + H2SO4 (разб.) → FeSO4 + H2↑
Во всех этих случаях легко образуются соли. Однако есть важное условие: чтобы реакция такого типа пошла в водном растворе, образующаяся соль должна быть растворима в воде. Если соль будет нерастворима, то ее частицы, образующиеся в начале реакции, покроют гранулы металла, блокируя их контакт с кислотой и препятствуя дальнейшему протеканию процесса. Поэтому в некоторых учебниках написано, что реакции вроде приведенных ниже не протекают:
Ba + H2SO4 → BaSO4↓ + H2↑ (реакция не идет)
3Zn + 2H3PO4 → Zn3(PO4)2↓ + 3H2↑ (реакция не идет)
Тем не менее в заданиях ЕГЭ на химические свойства неорганических свойствах, где для указанного соединения нужно подобрать ряд веществ, с которыми оно реагирует, такие реакции считаются корректными. Это действительно спорный вопрос. Подобные реакции действительно легко начинаются и некоторое время идут, но потом могут остановиться, если осадок соли покроет гранулы еще не прореагировавшего металла.
Если вместо кислоты-неокислителя взять кислоту-окислитель, то металл с ней тоже даст соль, но теперь исчезает требование к тому, чтобы металл в ряду активности находился до водорода. Кислоты-окислители – это HNO2, HClO, H2SO4 (концентрированная) и HNO3 (любой концентрации). Учитывая, что теперь реальным окислителем является атом кислотного остатка, в продуктах реакции будет не только соль, но и соединение, содержащее продукт восстановления этого атома. Например, с азотной кислотой реагирует серебро, хотя оно расположено правее водорода в ряду активности:
Ag + 2HNO3 → AgNO3 + NO2↑ + H2O
NO2, содержащее азот в степени окисления +4, - это продукт восстановления N+5 в азотной кислоте.
Важно помнить, что серная кислота меняет свои свойства в зависимости от концентрации. Концентрированная серная кислота – это кислота-окислитель, поэтому она реагирует с медью, расположенной правее водорода в ряду активности.
Cu + 2H2SO4 (конц.) → CuSO4 + SO2↑ + 2H2O
Однако разбавленная серная кислота является кислотой-неокислителем, поэтому с медью не реагирует:
Cu + H2SO4 (разб.) → реакция не идет
Тем не менее это не означает, что можно получить соли любого металла, если взять кислоту-окислитель. Например, золото с концентрированными серной кислотой и азотной кислотами не реагирует:
Au + H2SO4 (конц.) → реакция не идет
Au + HNO3 (конц.) → реакция не идет
3. Реакции металлов с растворами солей.
Ряд напряжения или активности металлов показывает относительную восстановительную способность этих металлов или окислительную способность их ионов. Если металл с более сильными восстановительными свойствами помесить в раствор с ионом металла, способным выступить по отношению к нему окислителем, то самопроизвольно протекает электрохимическая реакция, то есть ОВР. Можно сформулировать правило:
Более активный металл в ряду напряжений (то есть находящийся левее) вытесняет менее активный (то есть находящийся правее) из раствора его соли.
Можно привести примеры.
Cu + Hg(NO3)2 → Cu(NO3)2 + Hg↓
Zn + CuCl2 → ZnCl2 + Cu↓
Fe + AgNO3 → Fe(NO3)2 + Ag↓
Важно, что во всех этих случаях мы брали растворимые соли менее активных металлов. Если соль менее активного металла нерастворима, то вытеснения металла не происходит.
Zn + FeCO3 → ZnCO3 + Fe (реакция не идет, поскольку FeCO3 нерастворим)
Fe + AgCl → FeCl2 + Ag (реакция не идет, поскольку AgCl нерастворим)
Также необходимо отметить, что правило о вытеснении менее активных металлов более активными не распространяется на активные щелочные и щелочноземельные металлы. То есть реакция, приведенная ниже, не протекает:
K + NaCl → KCl + Na (реакция не идет)
Это совершенно понятно: ни существование металлического калия, ни существование металлического натрия в воде невозможно. Эти металлы легко взаимодействуют с водой с образованием гидроксидов. А полученный после помещения калия в воду гидроксид с хлоридом натрия не реагирует, потому что в этой реакции ионного обмена нет движущей силы (см. статью об ионном обмене). Однако реакции замещения с участием активных металлов могут протекать в твердой фазе, о чем свидетельствует лабораторная реакция получения алюминия, в которой хлорид алюминия сплавляется с калием:
3K + AlCl3 → 3KCl + Al (сплавление)
4. Реакции между оксидами металлов и неметаллов.
Если металл образует основный оксид, то возможна его реакция с кислотным оксидом неметалла. В этом случае образуется соль. Примеры приведены ниже:
Na2O + SO3 → Na2SO4
3K2O + P2O5 → 2K3PO4
CaO + N2O3 → Ca(NO2)3
В реакциях выше Na2O, K2O и CaO представляют собой основные оксиды, а SO3, P2O5, N2O3 – кислотные оксиды. В результате их взаимодействия образуются соли. В них кислотные остатки образованы кислотами, соответствующими кислотным оксидам.
Иногда такие реакции требуют высоких температур. Чтобы получить силикат кальция, нужно сплавлять основный оксид кальция и кислотный оксид кремния (IV):
CaO + SiO2 → CaSiO3 (сплавление)
Важно отметить, что все кислотные оксиды, разумеется, содержат кислород, но это не значит, что все оксиды неметаллов являются кислотными. Существует небольшая группа оксидов неметаллов, которые называются несолеобразующими. Эти оксиды не образуют кислот после взаимодействия с водой и не реагируют с щелочами в воде с образованием солей. Перечислим эти оксиды: N2O, NO, CO, SiO. Оксид NO2 в школьном курсе принято считать кислотным, потому что он реагирует с щелочами в воде, образуя соли – нитраты и нитриты. Но, строго говоря, азотсодержащей кислоты со степенью окисления азота +4, как в NO2, не существует. Основные оксиды металлов с несолеобразующими оксидами с образованием солей не реагируют.
Если рассматривать амфотерный оксид, то он способен реагировать как с основными, так и с кислотными оксидами. В первом случае в реакции с основным оксидом он будет проявлять кислотные свойства, а во втором случае в реакции с кислотным оксидом – основные. В обоих случаях будут образовываться соли, как показано ниже:
Al2O3 + CaO → Ca(AlO2)2 (Al2O3 проявляет кислотные свойства)
Al2O3 + SO3 → Al2(SO4)3 (Al2O3 проявляет основные свойства)
5. Реакции между оксидами металлов и кислотами.
Оксиды металлов, будь они основными или амфотерными, легко реагируют с сильными кислотами. При этом, как правило, процесс не является окислительно-восстановительными.
FeO + H2SO4 (разб.) → FeSO4 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
ZnO + 2HNO3 → Zn(NO3)2 + H2O
Впрочем, иногда процесс может стать окислительно-восстановительным, если металл в оксиде находится в промежуточной степени окисления, а кислота является сильным окислителем.
FeO + 4HNO3 (конц.) → Fe(NO3)3 + NO2↑ + 2H2O
Приведенные выше реакции протекают в растворах и в них участвуют сильные кислоты. Со слабыми кислотами подобные реакции могут протекать значительно труднее. Например ZnO реагирует с сероводородом H2S при температурах выше 800°С:
ZnO + H2S → ZnS + H2O
6. Реакции между оксидами неметаллов и щелочами.
Кислотные оксиды неметаллов реагируют с растворимыми основаниями, то есть щелочами с образованием солей. Основания – это те же основные оксиды, к которым добавили воду, поэтому такие реакции похожи на взаимодействие с основными оксидами. Разница только в том, что когда мы берем основания, выделяется вода.
CO2 + 2NaOH → Na2CO3 + H2O
SO3 + 2KOH → K2SO4 + H2O
N2O5 + Ca(OH)2 → Ca(NO3)2 + H2O
Если кислотному оксиду соответствует многоосновная кислота, то при недостатке основания можно получить кислую соль. Поэтому при изменении соотношения реагентов первые две реакции можно переписать следующим образом:
CO2 + NaOH → NaHCO3
SO3 + KOH → KHSO4
Для нерастворимых оснований, которые уже не являются щелочами по определению, реакции с кислотными оксидами могут быть затруднены. Например, гидроксид алюминия не реагирует с оксидами серы(IV) и углерода(IV):
Al(OH)3 + SO2 → реакция не идет
Al(OH)3 + CO2 → реакция не идет
7. Реакции между кислотами и щелочами.
Такие реакции называются реакциями нейтрализации и протекают чрезвычайно легко. В их результате всегда образуются соль и вода.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
KOH + HCl → KCl + H2O
NaOH + HNO3 → NaNO3 + H2O
Поскольку продуктом реакции является вода, образование соли в виде осадка не является необходимым условием для протекания процесса. Полученная соль вполне может быть и растворима, вода уже выступает движущей силой этого ионного обмена. Если кислота сильная, то в такую реакцию вступают не только щелочи, но и нерастворимые основания.
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O
Со слабыми кислотами реакция идет не всегда, что может быть связано в том числе с необратимым гидролизом образующейся соли. Например, гидроксид алюминия не реагирует с H2S:
Al(OH)3 + H2S → реакция не идет
8. Реакции между кислотами и солями.
Когда мы смешиваем в водном растворе кислоту и соль, мы ожидаем реакцию ионного обмена. Чтобы она пошла, необходимо наличие движущей силу ионообменного процесса – образование воды, газа, осадка или слабой кислоты. В ходе реакции кислоты и соли может получиться только новая соль и новая кислота. Если они представляют собой осадок или если новая кислота распадается в момент образования на воду и газ (как в случае H2SO3, H2CO3), то такой процесс легко идет.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Cu(NO3)2 + H2S → CuS↓ + 2HNO3
K2CO3 + HCl → 2KCl + CO2↑ + H2O
Na2SO3 + 2HNO3 → 2NaNO3 + SO2↑ + H2O
Если не образуются ни осадок, ни газ, то реакция c образованием новой соли не идет.
KCl + HNO3 → реакция не идет (среди теоретических продуктов нет газа, а KNO3 не является осадком)
CaBr2 + HCl → реакция не идет (среди теоретических продуктов нет газа, а CaCl2 не является осадком)
9. Реакции между щелочами и солями.
Щелочи или растворимые основания могут реагировать с солями, и тогда это тоже будет реакция ионного обмена. Значит, для протекания процесса снова нужна движущая сила. В такой реакции может образоваться только новое основание и новая соль. Если они будут осадками, то процесс пойдет. Но, как правило, осадком является новое основание.
Ba(OH)2 + Cu(NO3)2 → Ba(NO3)2 + Cu(OH)2↓
2NaOH + ZnCl2 → 2NaCl + Zn(OH)2↓
3KOH + AlBr3 → 3KBr + Al(OH)3↓
В последних двух реакциях необходимо брать недостаток щелочи. В ее избытке происходит растворение амфотерных гидроксидов цинка и алюминия:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Al(OH)3 + KOH → K[Al(OH)4]
Нерастворимые основания с солями в воде не реагируют.
Zn(OH)2 + NaCl → реакция не идет
Al(OH)3 + K2SO4 → реакция не идет
10. Реакции между двумя солями.
Между двумя солями тоже возможен ионный обмен. В подавляющем большинстве случаев продуктами будут две новые соли. Если хотя бы одна из них представляет собой осадок, реакция пойдет.
Sr(NO3)2 + K2SO4 → SrSO4↓ + 2KNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
2Na3PO4 + 3CaBr2 → Ca3(PO4)2↓ + 6NaBr
Есть также пара примеров реакций, когда взаимодействие двух солей из ионного обмена превращается в окислительно-восстановительный процесс. Речь идет о распаде образующихся в результате ионного обмена FeI3 и CuI2:
2Fe(NO3)3 + 6KI → 6KNO3 + 2FeI2 + I2↓
2Cu(NO3)2 + 4KI → 4KNO3 + 2CuI↓ + I2↓
А иногда в таком случае даже не образуется второй соли.
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O (при нагревании)
11. Разложение солей.
Некоторые соли способны разлагаться при нагревании с образованием других солей. Например, перманганат калия при нагревании дает манганат:
2KMnO4 → K2MnO4 + MnO2 + O2↑
Хлорат в присутствии катализатора дает хлорид:
2KClO3 → 2KCl + 3O2↑
А без катализатора - смесь хлорида и перхлората:
4KClO3 → KCl + 3KClO4
Сульфит натрия тоже разлагается с образованием двух солей:
4Na2SO3 → Na2S + 3Na2SO4
Нитраты калия и натрия разлагаются с образованием нитритов:
2NaNO3 → 2NaNO2 + O2↑
2KNO3 → 2KNO2 + O2↑
Правда, не все нитраты щелочных металлов разлагаются таким образом. Нитрат лития дает при разложении оксид:
4LiNO3 → 2Li2O + 4NO2↑ + O2↑
Также есть группа реакций получения средних солей путем разложения кислых. Например, разложением гидрокарбонатов можно получить средние карбонаты:
2NaHCO3 → Na2CO3 + CO2↑ + H2O
2KHCO3 → K2CO3 + CO2↑ + H2O
Итак, выше мы перечислили все основные реакции получения солей. Все примеры реакций, приведенные в этой статье, могут встретиться в ЕГЭ.
Хотите хорошо подготовиться к ЕГЭ по английскому или химии или изучать английский для себя? Запишитесь на занятия к автору сайта.
Занятия проходят онлайн, в удобном формате, в подходящее для Вас время.


